Foto: Dr. Elisabeth Jacobi-Gresser
Materialwissenschaftlicher Hintergrund
Titan zählt aufgrund seiner mechanischen Eigenschaften und erfolgreichen Osseointegration zu den am häufigsten eingesetzten Materialien in der dentalen Implantologie. Dennoch weist es materialbedingte Nachteile auf. Bei der Insertion und unter funktioneller Belastung kann es zur Freisetzung von Titanpartikeln durch Abrieb oder Korrosion kommen – insbesondere in Gegenwart von Speichel und mechanischer Beanspruchung.1 Diese Partikel interagieren mit Immunzellen im umliegenden Gewebe. Keramiken, insbesondere auf Basis von Y-TZP oder ZTA, bieten demgegenüber eine hohe chemische Stabilität, Abriebfestigkeit und Korrosionsresistenz. In spektrometrischen Analysen zeigte sich bei Zirkonoxidimplantaten im Gegensatz zu Titan kein signifikanter Partikelabrieb. Auch die Bruchfestigkeit moderner Keramiken ist laut Bethke et al. (2020)2 für den klinischen Einsatz ausreichend.
Abb. 1: Makrophagenaktivierung durch Titanpartikel.
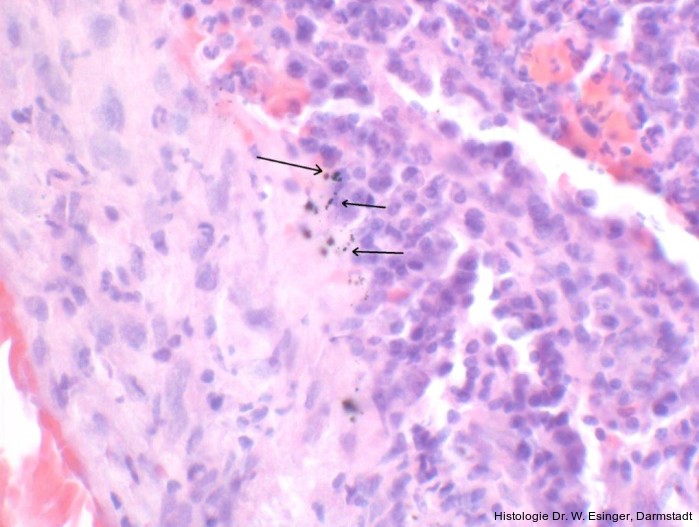
Abb. 2: Titanpartikel im periimplantären Weichgewebe, HE-Färbung, Mag. × 200.
Abb. 3: Aktivierte Makrophagen (rot) um Titanpartikel im periimplantären Weichgewebe, Histoimmunfärbung CD 68, Mag. × 200.
Abb. 4: Histologie der periimplantären entzündungsfreien Mukosa um Keramikimplantat, Mag. × 100.
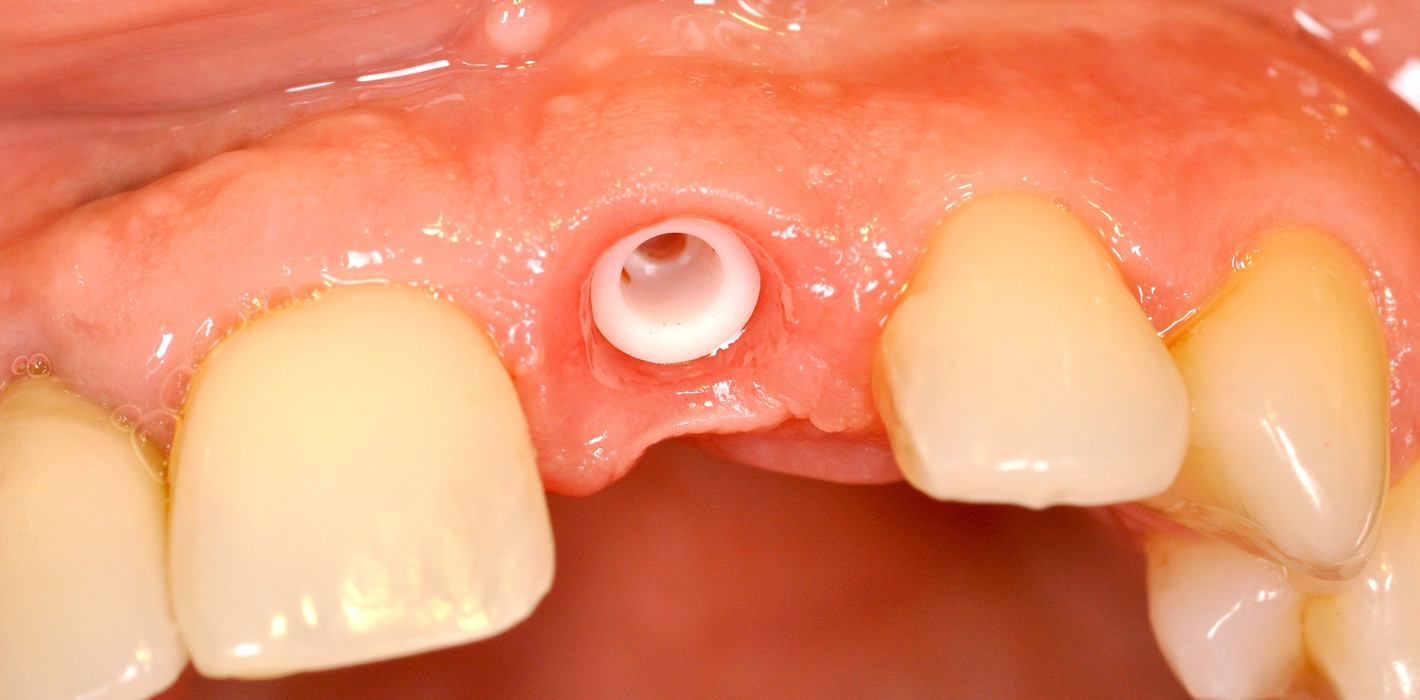
Abb. 5: Zahnentfernung 21 mit Alveolenstabilisierung 2011.
Abb. 6: Implantation 2012, Situs nach Implantatfreilegung.
Abb. 7: Stabiles periimplantäres Gewebe an 21 im Jahr 2016.
Abb. 8: Periimplantäre Gewebesituation an 21 nach zwölf Jahren, geringer vertikaler Mukosaverlust am natürlichen Nachbarzahn 11, während kein Gewebe-
verlust am Keramikimplantat zu verzeichnen ist. Regio 12 vor Implantatversorgung.
Immunologische Reaktionen und Entzündung
Die Freisetzung metallischer Partikel aus Titanimplantaten stellt einen zentralen Mechanismus in der Entstehung immunologischer Reaktionen im periimplantären Gewebe dar. Zahlreiche Studien belegen, dass Titanpartikel Immunzellen aktivieren und so entzündliche Prozesse auslösen können. In vitro wurde nachgewiesen, dass Titanpartikel die Sekretion proinflammatorischer Zytokine wie Interleukin-1β (IL-1β), Tumornekrosefaktor-α (TNF-α) und Interleukin-6 (IL-6) durch Makrophagen signifikant erhöhen.3
Diese Befunde deuten auf eine immunvermittelte Reaktion auf freigesetzte Titanpartikel hin. Ein systematischer Review von Noronha Oliveira et al. (2018)5 bestätigte diese Ergebnisse auf zellulärer Ebene. Die Autoren zeigten, dass durch Korrosion und mechanischen Abrieb freigesetzte Titanionen und -partikel von Immunzellen phagozytiert werden. Infolge dieser Aufnahmeprozesse entstehen oxidativer Stress, Zellschädigung und die Freisetzung proinflammatorischer Mediatoren, was letztlich zur Gewebedestruktion beitragen kann. Die Autoren betonen, dass sowohl Korrosionsvorgänge als auch tribologische Belastungen entscheidend zur Immunaktivierung rund um Titanimplantate beitragen. Auf molekularer Ebene belegten Pettersson et al. (2017),6 dass Titanionen in biologischen Umgebungen zu Partikeln aggregieren, die in lipopolysaccharid-voraktivierten Makrophagen das NLRP3-Inflammasom aktivieren. Dies führt zu einer starken Freisetzung von IL-1β, einem zentralen Entzündungsmediator, der maßgeblich an der Pathogenese der Periimplantitis beteiligt ist.
„Detaillierte Einblicke in die Gewebereaktionen lieferte eine retrospektive histopathologische Studie von Paparella et al. (2021). Dabei wurden periimplantäre Gewebeproben analysiert, in denen Titanimplantate zu klinischen Komplikationen geführt hatten. Die Autoren identifizierten sowohl intra- als auch extrazellulär lokalisierte Metallpartikel, die mit entzündlichen Zellinfiltraten, fibrotischen Umbauprozessen und vaskulären Veränderungen assoziiert waren.“
Im Gegensatz dazu zeigen keramische Werkstoffe eine deutlich geringere immunologische Reaktivität. Porporati et al. (2023)7 konnten nachweisen, dass Zirkonoxid-verstärkte Alumina-Keramik (ZTA) keine nennenswerte Aktivierung von humanen Makrophagen hervorruft. Auch auf transkriptioneller Ebene bestehen klare Unterschiede: Proteom- und Transkriptomanalysen belegen ein weniger proinflammatorisches zelluläres Antwortmuster bei Keramikoberflächen. In einer vergleichenden Analyse zeigten Elangovan et al. (2022),8 dass neutrophile Granulozyten auf Titanoberflächen eine deutlich stärkere Entzündungsantwort entfalten als auf Zirkonoxid, einschließlich der vermehrten Produktion reaktiver Sauerstoffspezies. Diese reaktiven Moleküle fördern chronisch-entzündliche Prozesse und können bestehende Gewebeschädigungen zusätzlich verschärfen.
Auf Grundlage dieser Erkenntnisse empfiehlt die deutsche S3-Leitlinie (Müller-Heupt et al., 2022)9 bei klinischem Verdacht auf Titanunverträglichkeit eine strukturierte immunologische Diagnostik. In entsprechenden Fällen sollte der Einsatz metallfreier keramischer Implantate bevorzugt werden, um potenzielle immunologische Komplikationen zu minimieren.
Weichgewebeintegration und bakterielle Interaktion
Die transmukosale Zone ist entscheidend für die langfristige Gesundheit und Stabilität periimplantärer Strukturen. Keramische Implantate fördern eine enge Weichgewebeanlagerung und zeigen in Studien eine geringere Plaqueakkumulation als Titanimplantate.10 Die glatte Oberfläche von Keramik reduziert die bakterielle Adhäsion signifikant. In einer randomisierten klinischen Studie verglichen Bienz et al. (2021)11 Titan- und Zirkonimplantate bei gesunden wie auch bei entzündlichen Verhältnissen. Zirkonoxid zeigte eine bessere Epithelanlagerung und geringere Entzündungszeichen. Die mikroraue Struktur von Titan hingegen erhöht die Affinität für orale Pathogene, was das Risiko für Periimplantitis steigert.
Langzeitverhalten und Alterung
Titanimplantate unterliegen Degradationsprozessen wie Korrosion oder galvanischen Effekten, insbesondere bei Kontakt mit anderen Metallen.12 Freigesetzte Ionen können zelltoxisch wirken und chronische Entzündungen fördern. Zirkonoxidkeramiken sind weitgehend inert, allerdings kann es unter Hydrothermalbedingungen zu einer sogenannten low-temperature degradation (LTD) kommen. Moderne Materialmodifikationen wie ZTA/ATZ minimieren dieses Risiko erheblich.7 Borges et al. (2020)13 zeigten in einer Metaanalyse, dass Zirkonimplantate vergleichbar geringe marginale Knochenverluste als Titan aufweisen.
„Zirkonoxidimplantate weisen in aktuellen Metaanalysen eine Zehn-Jahresüberlebensrate von über 95 Prozent auf.“
Klinische Relevanz und Indikationen
Zirkonoxidimplantate weisen in aktuellen Metaanalysen eine Zehn-Jahresüberlebensrate von über 95 Prozent auf.14 Auch bei dünnem Gingivabiotyp sind sie ästhetisch vorteilhaft, da sie nicht grau durchschimmern. Die internationale sowie die deutsche S3-Leitlinie9, 15 empfehlen ihren Einsatz bei nachgewiesener Titanunverträglichkeit, genetischer Entzündungsprädisposition oder auf ausdrücklichen Patientenwunsch nach einer metallfreien Lösung. Die systematische Übersicht von Comisso et al. (2021)16 bestätigt ebenfalls die Eignung von Zirkonoxid als gleichwertige Alternative zu Titan.
Fazit
Keramische Implantate bieten gegenüber Titan eine immunologisch und biologisch verträglichere Alternative. Die sehr geringe Partikelfreisetzung, die ausgezeichnete Weichgewebeintegration, die reduzierte bakterielle Besiedelung sowie die hohe Alterungsresistenz sprechen für ihren Einsatz – insbesondere bei immunologisch vorbelasteten oder ästhetisch anspruchsvollen Patienten. Die klinische Erfolgsrate ist inzwischen gut dokumentiert und vergleichbar mit Titanimplantaten. Der Einsatz keramischer Implantate sollte deshalb auf Grundlage individueller Risikofaktoren verstärkt in die zahnärztliche Implantologie integriert werden.
IJ Implantologie Journal
Dieser Fachbeitrag ist im IJ Implantologie Journal erschienen.
Als offizielle Mitgliederzeitschrift der Deutschen Gesellschaft für Zahnärztliche Implantologie e.V. (DGZI) hat sich das Journal kontinuierlich als eine der führenden Publikationen im Dentalbereich etabliert und dient nicht nur als Informationsquelle, sondern auch als zentrale Plattform für das gesamte Themenspektrum rund um Implantologie, Parodontologie und Prothetik.