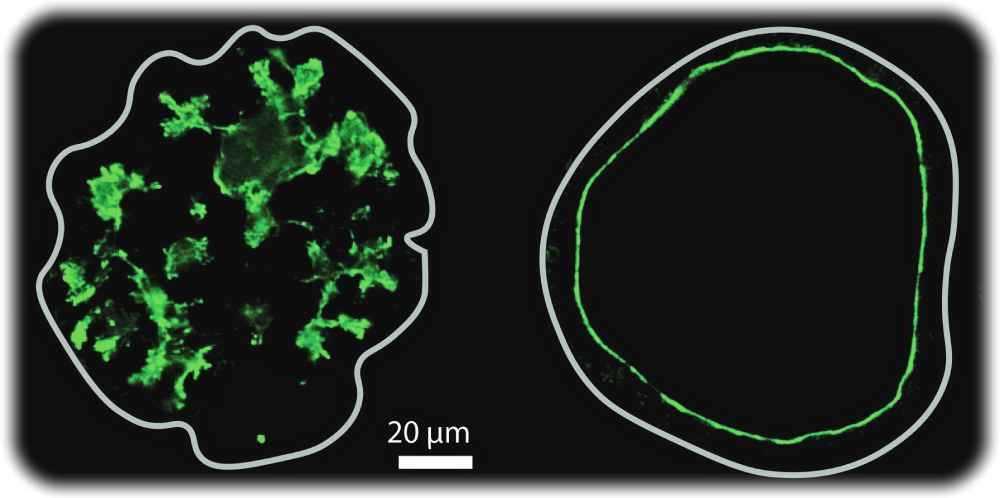
Mikroskopische Aufnahme mit einem sternförmigen Lumen auf der linken Seite und einem kugelförmigen Lumen auf der rechten Seite, bei dem Druck und Zellwachstum gewirkt haben. Aufnahme: Byung Ho Lee et al. / MPI-CBG / Nature 2025 via MPI-CBG
Dresdner Biologen sehen möglichen Pfad für neue Therapien
Dresden, 11. Januar 2026. Durch systembiologische Forschungen wird immer deutlicher: Es ist oft ein Zusammenwirken kleiner physikalischer, chemischer und genetischer Effekte, die aus bloßen Molekülen entstehenden Lebewesen formen und strukturieren. So ist es jedenfalls auch Falle der Bauchspeicheldrüse: Deren Flüssigkeits-Hohlräume („Lumen“) bekommen ihre besondere Form und Struktur durch „drei Hauptfaktoren: der Wachstumsgeschwindigkeit der Zellen, dem Druck im Lumen und der Durchlässigkeit der Zellen rund um das Lumen“, erklärt Direktorin Anne Grapin-Botton vom Max-Planck-Institut für molekulare Zellbiologie und Genetik (MPI-CBG) in Dresden. Ihr internationales Forscherkollektiv hat dies durch Simulationen und Experimente an Organoiden, also gezüchteten Organvorstufen, in einer Studie ermittelt.
Wirkstoffe können gezielt Hohlräume verändern
„Dreidimensionale Strukturen der Bauchspeicheldrüse, sogenannte Bauchspeicheldrüsenorganoide, können je nach Medium in der Petrischale entweder große kugelförmige Lumen oder enge, komplexe, miteinander verbundene Lumenstrukturen bilden“, erklärt Studien-Hauptautor Byung Ho Lee. „Durch Zugabe bestimmter chemischer Wirkstoffe, die die Zellerneuerungsrate und den Druck im Lumen verändern, konnten wir die Form des Lumens verändern. Durch die Erhöhung der Durchlässigkeit der Epithelzellen, die das Lumen umgeben, wird der Druck gesenkt und die Form des Lumens verändert.”
„Unser Modell kann die Parameter messen und vorhersagen, die für die Veränderungen der Lumenformen verantwortlich sind, und so Feedback für die Experimente selbst liefern.“
Doktorandin Kana Fuji in der Forschungsgruppe von Masaki Sano
„Krankheiten besser verstehen und behandeln“
Anne Grapin-Botton sieht in der Studie einen Schlüssel für ein tieferes Verständnis auch krankhafter Veränderungen der Bauchspeicheldrüse: „Diese Erkenntnis könnte uns helfen zu verstehen, wie sich andere Organe mit engen, miteinander verbundenen Kanälen entwickeln und wie sich häufige zystische Erkrankungen auf sie auswirken“, schätzt die Direktorin ein.
Prof. Dr. Anne Grapin-Botton. Foto: Katrin Boes, MPI-CBG
„Unser Modellsystem könnte die Forschung auf dem Gebiet der Organentwicklung und des Tissue Engineering vorantreiben und möglicherweise auch dazu verwendet werden, zu testen, wie verschiedene Medikamente auf Krankheiten wirken, was wiederum zu neuen Behandlungsmethoden führen könnte. Dadurch könnten wir Krankheiten, die die Bauchspeicheldrüse und andere Organe mit verzweigten Kanälen betreffen, besser verstehen und behandeln.“
Autor: hw
Quellen: MPI-CBG, Wikipedia, Oiger-Archiv
Wissenschaftliche Publikation:
„Permeability-driven pressure and cell proliferation control lumen morphogenesis in pancreatic organoids“ von Byung Ho Lee, Kana Fuji, Heike Petzold, Phil Seymour, Siham Yennek, Coline Schewin, Allison Lewis, Daniel Riveline, Tetsuya Hiraiwa, Masaki Sano und Anne Grapin-Botton, in: „Nature Cell Biology“ (2025), Fundstelle im Netz: doi: 10.1038/s41556-025-01832-5

Ihre Unterstützung für Oiger.de!
Ohne hinreichende Finanzierung ist unabhängiger Journalismus nach professionellen Maßstäben nicht dauerhaft möglich. Bitte unterstützen Sie daher unsere Arbeit! Wenn Sie helfen wollen, Oiger.de aufrecht zu erhalten, senden Sie Ihren Beitrag mit dem Betreff „freiwilliges Honorar“ via Paypal an:
Vielen Dank!