Redacción
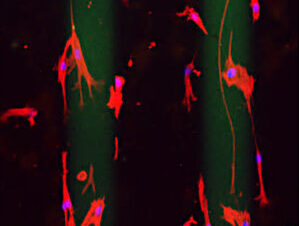
La llamada durotaxis, migración celular impulsada por gradientes de rigidez, es clave en la metástasis del cáncer de páncreas y la acumulación de tejido cicatricial en fibrosis pulmonar, cutánea y renal. Así, la rigidez no indica sólo la presencia de los tumores sino que actúa como motor que guía la metástasis y la progresión de la fibrosis a través de un proceso celular llamado durotaxis.
Así se desprende de un nuevo estudio publicado en Nature Cell Biology, liderado por el científico español David Lagares, desde Harvard Medical School. La investigadora Alba Santos, coautora del estudio, realizó experimentos clave de este nuevo trabajo durante el inicio de su tesis en el Centro de Biología Molecular Severo Ochoa (CBM, CSIC-UAM), bajo la codirección de Santiago Lamas, investigador del CBM, y de David Lagares, antes de incorporarse al laboratorio de Harvard.
En el marco de este estudio los investigadores observaron que regiones peri-tumorales del microambiente tumoral se caracterizan por ser áreas de gran rigidez, creando caminos preferenciales para que las células tumorales se desplacen e inicien metástasis en órganos distales.
Los investigadores observaron que las regiones peri-tumorales del microambiente tumoral tienen gran rigidez, lo que crea caminos preferenciales para el desarrollo de la metástasis
Así, para demostrar que este fenómeno ocurre en organismos vivos y no solo en experimentos de laboratorio in vitro, el equipo empleó ratones modificados genéticamente y un fármaco experimental, JP-153 cuyo mecanismo de acción bloquea de manera específica un mecano-sensor expresado en células tumorales, formado por la unión de las proteínas FAK y paxilina. El resultado fue contundente: inhibir la durotaxis tumoral redujo de manera significativa del número de metástasis desde el páncreas hacia el hígado.
Este hallazgo cobra especial importancia puesto que en el cáncer de páncreas, uno de los más letales y con peor pronóstico, los subtipos más agresivos —los llamados quasi-mesenquimales— sobreexpresan el mecano-sensor FAK-paxilina, lo que les permite aprovechar estas rutas rígidas para expandirse. Gracias a esta observación abre la posibilidad de utilizar tanto la expresión de FAK-Paxillin como la rigidez del microambiente tumoral como biomarcadores para predecir la evolución de la enfermedad y seleccionar qué pacientes podrían beneficiarse más de terapias dirigidas contra este mecanismo.
Con este descubrimiento se abre un nuevo paradigma en la lucha contra el cáncer y la fibrosis. Y es que, hasta el momento la mayoría de tratamientos se centraban en atacar mutaciones genéticas o bloquear moléculas específicas. Los resultados de este trabajo muestran que también es posible diseñar fármacos mecano-terapéuticos, pensados para alterar la interacción entre las células y las fuerzas físicas del tejido que alimentan la progresión de la enfermedad. Si se confirma en ensayos clínicos, esta estrategia podría cambiar radicalmente el abordaje de patologías tan agresivas como el cáncer pancreático y de enfermedades fibróticas que hoy no tienen cura.