 @CireniaSketches / CNIO.
@CireniaSketches / CNIO.
Felipe Cortés, investigador principal del grupo del CNIO que ha creado el ‘reparoma’ humano explica cómo se hizo y el por qué de este trabajo, publicado en ‘Science’
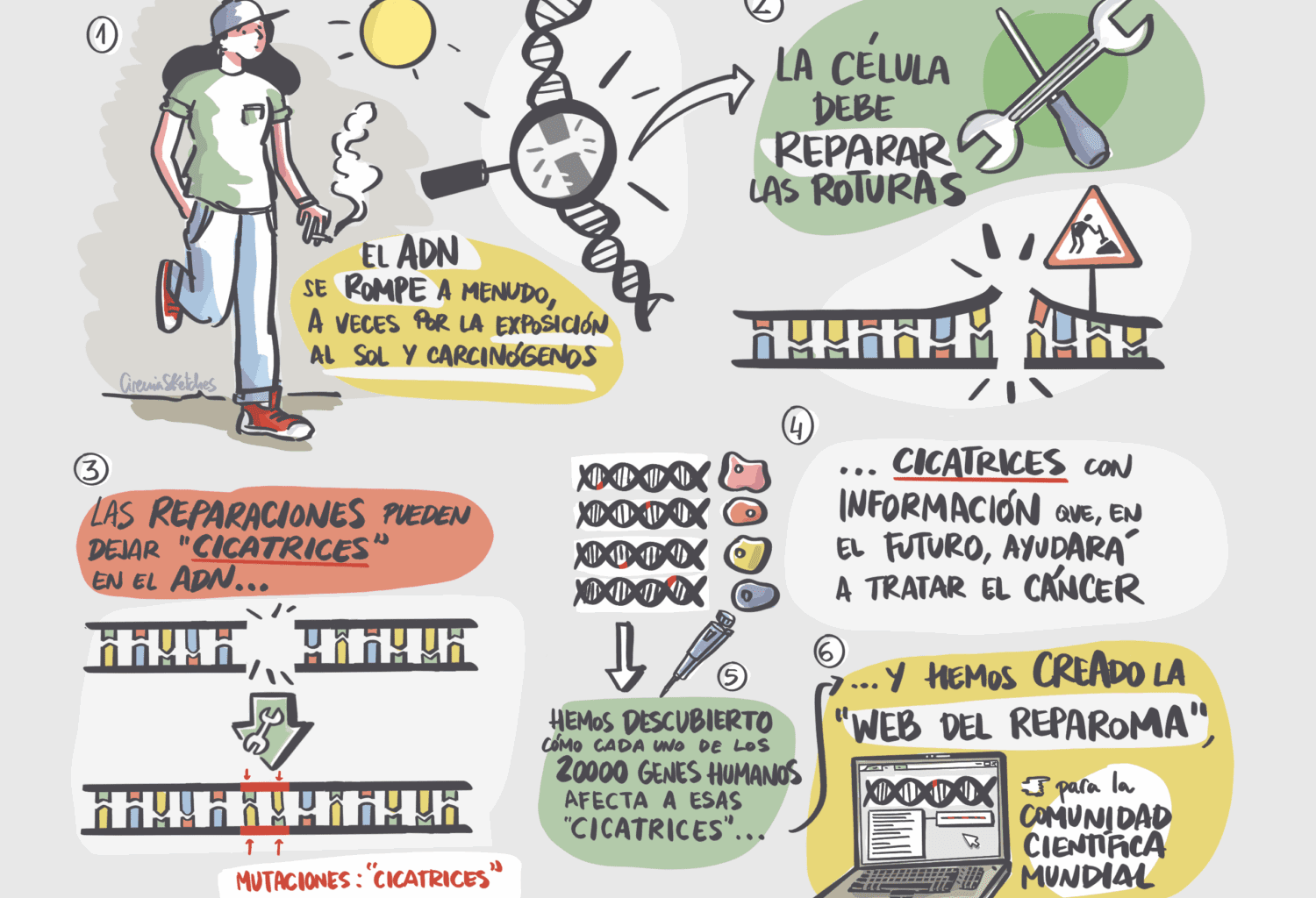
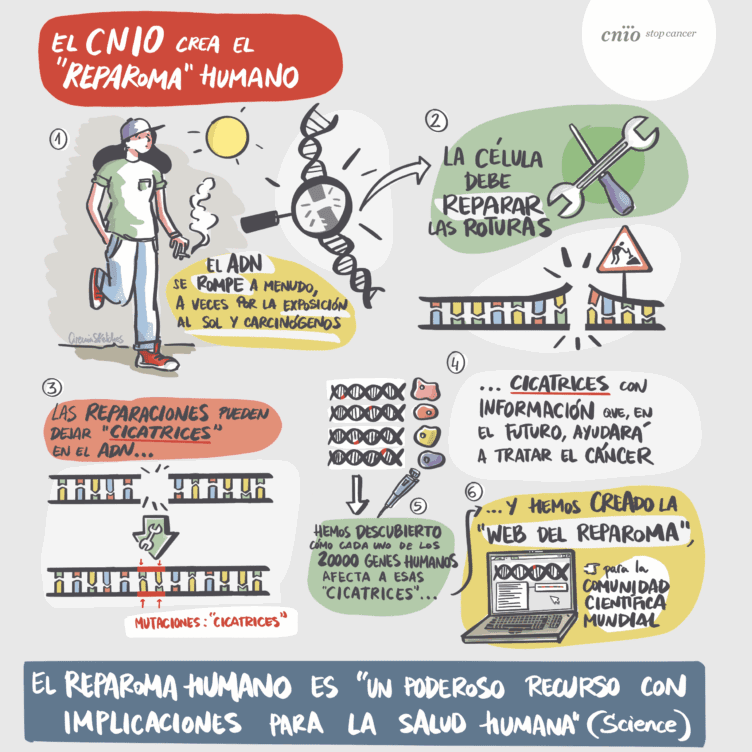
El reparoma humano (REPAIRome en inglés) es el conjunto de los 20.000 tipos de cicatrices que quedan en el ADN humano al ser reparado después de una rotura
Son autores del trabajo, además, Ernesto López e Israel Selguero, del grupo de Topología y Roturas de ADN del CNIO; y Daniel Giménez, del Grupo de Dinámica Cromosómica del CNIO.
El investigador del Centro Nacional de Investigaciones Oncológicas (CNIO) Felipe Cortés responde aquí preguntas básicas sobre el reparoma humano, que se presenta en un artículo publicado en Science. Son autores del trabajo, además, Ernesto López e Israel Selguero, del grupo de Topología y Roturas de ADN del CNIO; y Daniel Giménez, del Grupo de Dinámica Cromosómica del CNIO.
El reparoma humano (REPAIRome en inglés) es el conjunto de los 20.000 tipos de cicatrices que quedan en el ADN humano al ser reparado después de una rotura. El grupo del CNIO ha identificado estas cicatrices –son las mutaciones que quedan en el ADN después de la reparación–, y las ha puesto a disposición de la comunidad científica mundial a través de la web.
Pregunta: Explicáis que las cicatrices que quedan en el ADN tras ser reparado varían según qué genes falten en ese ADN. Y el ‘reparoma humano’ contiene todos los patrones de cicatrices posibles. Lo habéis creado apagando un gen diferente en 20.000 poblaciones celulares distintas; generando roturas en el ADN de las células; y observando sus cicatrices después de la reparación. ¿A quién se le ocurrió emprender esta investigación tan ambiciosa, y por qué?
Respuesta: La idea se me ocurrió en 2015, antes de estar en el CNIO. Debe de hacer diez años justo ahora porque fue en vacaciones. Ya existía la tecnología de análisis masivo para eliminar cada uno de nuestros genes, y comprobar efectos relativamente simples como crecimiento, sensibilidad a fármacos, etc. Hicimos algún intento previo, pero hasta que no nos incorporamos al CNIO y empezaron Ernesto, Israel y Daniel a trabajar en el proyecto, no se dieron las circunstancias para poder empezar en serio.
Empleamos un truco sencillo. Con la tecnología de edición genética CRISPR-Cas generamos de forma simultánea listas de cientos de reparaciones que se producían cuando faltaba cada uno de los 20.000 genes. Desde el principio sabíamos que tenía que funcionar, y que sería un avance importante. La duda era si íbamos a poder hacerlo a gran escala. Y empezamos con experimentos previos para determinarlo.
¿Otros grupos en el mundo también lo estaban intentando?
En 2021, justo cuando teníamos ya las condiciones puestas a punto, salió un estudio en Cell que usaba nuestra misma tecnología, pero en un grupo reducido de genes (unos 400) de los que ya se conocía que tenían una función en la reparación del ADN.
Fue un inconveniente importante, porque las revistas top valoran fundamentalmente la novedad y podía limitar nuestra publicación futura. Pero finalmente decidimos seguir adelante, porque ese estudio, al limitarse a genes con función conocida, no aportaba mucho al conocimiento de los mecanismos de reparación. Pensamos que hacerlo con todos los genes, además de generar una herramienta de consulta muy útil para toda la comunidad científica, podría resultar en nuevos descubrimientos, como así ha sido.
¿Habéis tardado lo que habíais previsto?
Desde que tomamos esta decisión el proceso ha sido muy rápido, teniendo en cuenta la envergadura del proyecto: solo cuatro años desde el inicio del experimento hasta tener la publicación es realmente muy poco tiempo.
Sabemos que hay al menos otro grupo que también ha realizado un estudio similar, aunque todavía no lo han publicado. Los resultados serán complementarios porque, hasta donde sabemos, lo han realizado en una línea celular diferente. En nuestro estudio ya vemos que las cicatrices cambian de unos tipos celulares a otros.
Tenemos el proteoma humano, el interactoma, el transcriptoma… ¿Qué peso tiene el reparoma entre todas esas ‘ómicas’?
Es una nueva capa de conocimiento genómico que puede integrarse con todas estas otras. Por ejemplo, es muy interesante comparar la similitud entre patrones en el reparoma con el interactoma conocido. Se observa que factores que forman parte de un mismo complejo, o con interacciones funcionales relevantes, tienen un impacto parecido en las cicatrices.
De hecho, es algo que hemos utilizado para identificar nuevos genes implicados en reparación, y este análisis de interacciones funcionales está integrado en nuestra web de consulta del reparoma.
 Desde la izda.: Ernesto López, Felipe Cortés, Daniel Giménez e Israel Selguero. / Marina Bejarano. CNIO.
Desde la izda.: Ernesto López, Felipe Cortés, Daniel Giménez e Israel Selguero. / Marina Bejarano. CNIO.
¿Qué preguntas ayudará a resolver el reparoma a corto plazo? ¿Y más allá?
De forma inmediata puede usarse como una herramienta de consulta. Por ejemplo, si se identifica un gen del que se sospecha que puede tener una función en reparación de roturas, o que puede afectar a la acumulación de mutaciones en cáncer, se podría confirmar simplemente mirando en la web del reparoma.
A corto-medio plazo se pueden emplear los datos generados para identificar nuevos factores y relaciones entre rutas de reparación, posibles explicaciones a patrones mutacionales y dianas terapéuticas para el tratamiento del cáncer. En la publicación solo hemos seleccionado, validado y caracterizado una serie de ejemplos para ilustrar lo que el reparoma puede hacer; hay mucha más información ahí que ahora está disponible a toda la comunidad científica.
Conceptualmente, ¿por qué la célula ha aprendido a reparar roturas, en lugar de a evitarlas?
También hay mecanismos para evitarlas. Pero es inevitable que algunas ocurran. Es curioso, pero la célula también usa las roturas de forma activa para procesos en los que necesita generar variabilidad genética.
Es el caso de la formación de gametos, que genera variabilidad para la siguiente generación, y la maduración de linfocitos, que generan un repertorio suficientemente variable y extenso de receptores y anticuerpos que puedan reconocer a cualquier patógeno. En estos casos se promueven tipos de reparación muy propensos a generar cicatrices.
¿Por qué es importante entender los mecanismos de reparación de roturas?
Tienen implicaciones directas muy relevantes para la salud. La reparación incorrecta resulta en acumulación de mutaciones e inestabilidad genómica, que están estrechamente relacionadas con el desarrollo y la progresión tumoral, y también con el envejecimiento.
Por otro lado, muchos de los agentes antitumorales clásicos se basan en matar a las células cancerosas induciendo roturas en su ADN, por lo que los factores encargados de la reparación de estas roturas son buenas dianas para aumentar la eficacia de estos tratamientos.
En este sentido, como hay varias formas diferentes de reparar las roturas, conocer los mecanismos de reparación activos en cada tumor es muy relevante para diseñar tratamientos personalizados. Aunque de forma más indirecta, los mecanismos de reparación también influyen en la inmunogenicidad tumoral, y por tanto en los tratamientos de inmunoterapia.
Finalmente, la generación dirigida de roturas en el ADN es la base de la edición génica por las tecnologías CRIPS-Cas y, de hecho, es lo que hemos usado para generar el reparoma. Conocer los mecanismos de reparación es por tanto fundamental para el desarrollo de técnicas de edición génica eficientes y controladas.
¿Por qué las cicatrices en el ADN reparado son distintas según qué genes estén o no en el ADN?
Los genes que estén o no en el ADN van a determinar las proteínas que estén presentes para reparar la rotura en la célula. Existen numerosas rutas para reparar las roturas que se apoyan, solapan y compiten entre ellas. Cada una depende de múltiples proteínas de forma directa, y también de factores indirectos, como el estado general de la célula. Las ausencia o presencia de cada una de estas proteínas va a determinar qué rutas de reparación se empleen y, por tanto, el resultado final de la reparación.
El reparoma humano está a disposición de la comunidad científica internacional. ¿Qué area de investigación crees que recurrirá a esta web en primer lugar?
Va a atraer la atención inmediata de los campos de la reparación del ADN e inestabilidad genómica y de las tecnologías CRISPR y edición génica. Esperamos que también atraiga a los interesados en la evolución tumoral. Poco a poco pensamos que puede convertirse en una herramienta de referencia para el resto de la comunidad científica.
¿Cuál será el paso siguiente de vuestra investigación?
Nuestra idea ahora es expandir los resultados con nuevos tipos celulares y condiciones específicas, combinando la inactivación de varios genes y añadiendo más mutaciones a nuestro análisis.
Con una cantidad de datos suficientemente extensa, y aplicando modelos de IA, deberíamos ser capaces de “decodificar” la relación entre el estado genético y patrones mutacionales en condiciones reales más complejas que la ausencia de genes individuales, que es el primer paso que hemos dado ahora. Esto tendría una gran relevancia para establecer tratamientos personalizados, predecir la evolución de tumores y controlar de forma precisa la edición génica.
Sobre el Centro Nacional de Investigaciones Oncológicas (CNIO)
El Centro Nacional de Investigaciones Oncológicas (CNIO) es un centro público de investigación dependiente del Ministerio de Ciencia, Innovación y Universidades. Es el mayor centro de investigación en cáncer en España y uno de los más importantes en Europa. Integra a medio millar de científicos y científicas, más el personal de apoyo, que trabajan para mejorar la prevención, el diagnóstico y el tratamiento del cáncer.
Artículo de referencia
Ernesto López de Alba, Israel Salguero, Daniel Giménez- Llorente, Javier Montes-Torres, Ángel Fernández- Sanromán, Ester Casajús- Pelegay, José Terrón- Bautista, Jonathan Barroso- González, Juan A. Bernal, Geoff Macintyre, Rafael Fernández- Leiro, Ana Losada, Felipe Cortés- Ledesma, A comprehensive genetic catalog of human double-strand break repair, Science, 2 october 2025
DOI: 10.1126/science.adr5048