- A casi una década del brote de Zika en las Américas en 2015-2016, el virus continúa representando un riesgo importante para la salud pública mundial. Pese al descenso en la incidencia global, persisten múltiples desafíos científicos, clínicos y logísticos para prevenir futuras epidemias y mitigar sus consecuencias, especialmente en mujeres embarazadas y recién nacidos.
- Actualmente, no existen vacunas ni tratamientos específicos aprobados para uso generalizado, lo que subraya la importancia de una estrategia coordinada de investigación y desarrollo.
- En la presente noticia se actualiza una agenda prioritaria que aborda los principales vacíos de conocimiento y se proponen medidas específicas en áreas críticas: vacunas y anticuerpos monoclonales, diagnóstico, vigilancia, infraestructura de investigación, control vectorial y políticas de salud pública.
- Se presentan los principales avances, desafíos y prioridades emergentes en el abordaje del virus Zika desde una perspectiva clínica, epidemiológica y translacional.
-oOo-
Zika: un virus neurotropo y teratogénico con dinámica epidémica impredecible
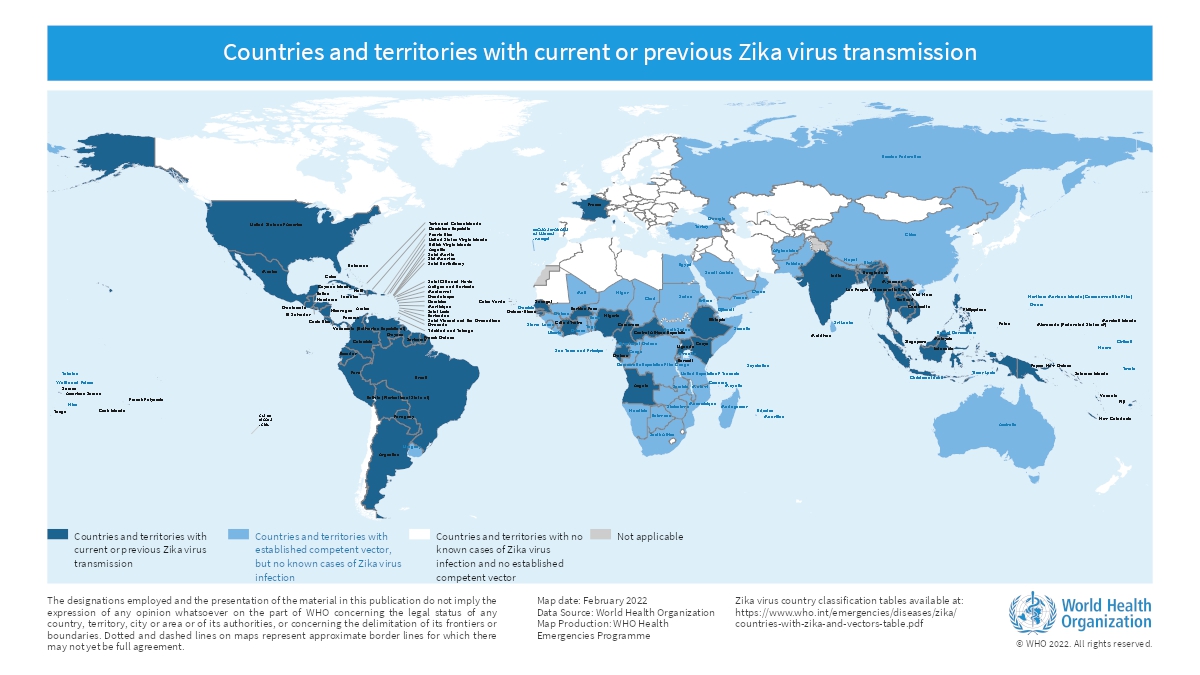
El virus Zika, un Orthoflavivirus transmitido principalmente por mosquitos del género Aedes, mostró su potencial epidémico y teratogénico durante el brote de 2015-2016 en el continente americano. Sus consecuencias más graves se observan en la gestación, con riesgo de microcefalia, defectos estructurales, pérdida fetal, parto prematuro y secuelas neurológicas de diverso grado. Además, se han descrito complicaciones en adultos, como el síndrome de Guillain-Barré y encefalitis.
Desde 2016, se ha documentado transmisión autóctona en 92 países y territorios de las Américas, Asia, África y Oceanía. Aunque la incidencia ha disminuido, la elevada proporción de población inmunológicamente naïve y la expansión de vectores competentes hacen prever que nuevas epidemias podrían emerger en cualquier momento.
Vacunas: diversidad tecnológica, desafíos regulatorios
Candidatos en evaluación clínica
A finales de 2024, se han completado 20 ensayos clínicos fase 1 con distintas plataformas: vacunas inactivadas, atenuadas, de ARNm, ADN, vectores virales y péptidos recombinantes. Todas han mostrado perfiles de seguridad aceptables y capacidad inmunogénica, aunque con variabilidad en títulos de anticuerpos neutralizantes según la plataforma, dosis y estado inmunológico del receptor frente a otros flavivirus.
Tres vacunas llegaron a la fase 2, pero ninguna se completó como estaba previsto: una fue retirada por razones comerciales (TAK-426 de Takeda), otra por falta de financiación (mRNA-1893 de Moderna), y la tercera (VRC5283 del NIAID) terminó sin evaluación de eficacia por la baja incidencia de casos.
Los avances en plataformas de administración (ARNm, ADN plasmídico, nanopartículas lipídicas) podrían facilitar una producción rápida y escalable ante situaciones de emergencia. Además, se están estudiando anticuerpos monoclonales (mAbs) modificados para evitar el riesgo de potenciación dependiente de anticuerpos (ADE), fenómeno que podría exacerbar infecciones por dengue en individuos previamente inmunizados o infectados por Zika.
Obstáculos para avanzar a fase 3
El descenso de la transmisión del virus ha hecho inviable la realización de ensayos de eficacia con criterios clínicos (como prevención del síndrome congénito por Zika), por la necesidad de muestras extremadamente grandes. Por ello, se proponen enfoques alternativos: modelos de infección humana controlada, estudios con marcadores sustitutos (como títulos de anticuerpos neutralizantes), y vigilancia poscomercialización en contextos de brotes.
Anticuerpos monoclonales: puente estratégico hasta la vacuna
Los mAbs se perfilan como una herramienta clave para ofrecer protección inmediata, sobre todo en mujeres embarazadas o en edad fértil, viajeros, pacientes inmunodeprimidos y personas no candidatas a vacunación. Actualmente, dos mAbs (Tyzivumab y dMAb-ZK190) han completado fase 1, aunque sin resultados publicados y con falta de pacientes infectados por Zika; y un tercer producto, una inmunoglobulina policlonal (ZIKV-Ig), demostró buena tolerancia en voluntarios.
Entre los criterios buscados destacan:
- Alta potencia con dosis bajas
- Duración de protección mínima de 6 meses
- Administración intramuscular o subcutánea
- Producción coste-efectiva para contextos de bajos recursos
Desafíos en la evaluación clínica: ¿cómo demostrar eficacia en un entorno de baja circulación?
La baja incidencia actual del virus impide la realización de ensayos de eficacia con criterios clínicos tradicionales, como la prevención del síndrome congénito por Zika. Este síndrome, aunque devastador, ocurre en menos del 10 % de los embarazos afectados, lo que requiere tamaños muestrales extremadamente grandes. Además, la co-circulación de otros flavivirus (como dengue) complica la evaluación serológica por reactividad cruzada.
Como respuesta, se propone la validación de correlatos inmunológicos de protección, el uso de modelos animales (especialmente primates no humanos) y el diseño de ensayos controlados de infección humana en entornos seguros (estudios de exposición controlada o de desafío), que permitirían avanzar en la regulación y aprobación de productos en ausencia de brotes activos.
Diagnóstico: limitaciones serológicas y necesidad de nuevas tecnologías
El diagnóstico de infección por el virus Zika sigue siendo un reto clínico importante. Las pruebas moleculares (RT-PCR) tienen una ventana diagnóstica estrecha (1-7 días en sangre), mientras que las serológicas (IgM, IgG) presentan alta reactividad cruzada con otros orthoflavivirus, como el dengue y la fiebre amarilla.
Se están investigando métodos que mejoren la especificidad, como ensayos basados en antígenos NS1 o dominios específicos de la proteína E. La implementación de plataformas multiplexadas y pruebas en el punto de atención es una prioridad, especialmente en zonas endémicas y de bajos recursos.
La creación de una red global de evaluación de diagnóstico, junto con una revisión de las directrices de la OMS, permitiría estandarizar la validación de nuevas tecnologías y su implementación clínica.
Vigilancia, infraestructura y coordinación global

La vigilancia epidemiológica se ha debilitado tras la epidemia de 2016, en parte por la disminución de casos y la reasignación de recursos a otras prioridades sanitarias. Esto ha afectado la capacidad de detección temprana, la identificación de brotes emergentes y la planificación de estudios clínicos.
Sin embargo, las enfermedades arbovirales representan una amenaza creciente para la salud mundial, especialmente en el contexto del cambio climático, la urbanización y la creciente movilidad humana. Por ello, es necesario fortalecer los sistemas de vigilancia integrada de arbovirus, incorporando técnicas innovadoras, como la vigilancia en aguas residuales, encuestas de serovigilancia poblacionales y estudios genómicos.
La adopción de definiciones clínicas estandarizadas y algoritmos diagnósticos regionales también es esencial para la vigilancia clínica y de laboratorio. De hecho, es fundamental que los profesionales sanitarios tengan acceso a recomendaciones basadas en la evidencia para gestionar eficazmente estas infecciones en los pacientes.
Impacto fetal: el gran desafío de la prevención
El objetivo primario de cualquier medida sanitaria contra el Zika es evitar la infección congénita. No obstante, demostrar la protección fetal es extremadamente complejo.
Además de las limitaciones diagnósticas, muchas de las secuelas (como trastornos del neurodesarrollo) se manifiestan a largo plazo, lo cual exige cohortes de seguimiento y biomarcadores predictores que aún no están disponibles.
Estudios longitudinales bien diseñados, con criterios estandarizados de evaluación fetal y seguimiento infantil, serán fundamentales para comprender la historia natural de la infección congénita, definir correlatos inmunológicos y validar la efectividad de vacunas o mAbs en prevenir el daño fetal.
Control vectorial: un componente crítico e infraestimado
El control de Aedes aegypti sigue siendo un pilar importante en la prevención del Zika y otros arbovirus. Sin embargo, las estrategias tradicionales han mostrado eficacia limitada en reducir la transmisión. El desarrollo de métodos innovadores, como la liberación de mosquitos infectados con Wolbachia, la técnica del insecto estéril o los repelentes espaciales, se encuentra en marcha, pero requiere más investigación y validación en entornos reales.
Se requiere evidencia sólida sobre el impacto poblacional de estas intervenciones y sobre su implementación sostenible, con participación comunitaria y respaldo institucional.
Conclusiones
El virus Zika continúa siendo una amenaza para la salud pública mundial. La ausencia de vacunas, terapias específicas y diagnósticos fiables obstaculiza una respuesta efectiva ante futuras epidemias.
Para los profesionales sanitarios, especialmente en entornos con presencia de Aedes aegypti, es crucial mantenerse informados sobre las actualizaciones en diagnóstico, vigilancia, inmunización y manejo de la infección durante la gestación.
El fortalecimiento de redes clínicas, de investigación y vigilancia, junto con el desarrollo de productos adaptados a contextos de bajos recursos, permitirá avanzar hacia una preparación real frente a un posible resurgimiento del Zika.
-oOo-
Más información en esta web
Referencias bibliográficas y enlaces recomendados
- Boeras D, et al. Evaluation of Zika rapid tests as aids for clinical diagnosis and epidemic preparedness. EClinicalMedicine 2022.
- Cardona-Trujillo MC, et al. Recent molecular techniques for the diagnosis of Zika and Chikungunya infections: a systematic review. Heliyon 2022.
- de Oliveira WK, et al. Infection-related microcephaly after the 2015 and 2016 Zika virus outbreaks in Brazil: a surveillance-based analysis. Lancet 2017; 390: 861–70.
- Halani S, et al. Clinical manifestations and health outcomes associated with Zika virus infections in adults: a systematic review. PLoS Negl Trop Dis 2021.
- Lackritz E, et al. Zika virus: advancing a priority research agenda for preparedness and response.The Lancet Infectious Diseases, 2025.
- Li A, et al. Zika Virus: Research Priorities for Preparedness and Response 3. Role of non-human primate models in accelerating research and developing countermeasures against Zika virus infection. Lancet Microbe 2025.
- Ostrowsky, Julia TAdams Waldorf, Kristina M, et al. Zika virus vaccines and monoclonal antibodies: a priority agenda for research and development. The Lancet Infectious Diseases, 2025.
- WHO. Guidelines for clinical management of arboviral diseases: dengue, chikungunya, Zika and yellow fever. Geneva: World Health Organization; 2025.
- WHO. Zika epidemiology update—February 2022. Feb 8, 2022. https://www.who.int/publications/m/item/zika-epidemiologyupdate—february-2022 (accessed Aug 1, 2025).
- WHO. Zika virus research and development (R&D) roadmap. Aug 31, 2021. https://www.who.int/publications/m/item/zikavirus-research-and-development-(r-d)-roadmap (accessed Oct 1, 2025).