El cáncer de mama no solo invade los tejidos no solo invade los tejidos circundantes o accede al torrente sanguíneo para propagarse. También aprovecha la compleja red del sistema linfático para alcanzar los ganglios linfáticos cercanos—los primeros centinelas defensivos del organismo— y, desde allí, dispersarse hacia otras regiones del cuerpo.
Un estudio reciente realizado por investigadores de la Universidad de Turku, el Hospital Universitario de Turku y el consorcio InFLAMES (Finlandia) aporta una visión inédita sobre este proceso: el tumor es capaz de remodelar profundamente los vasos linfáticos, alterando su biología y favoreciendo un entorno más permisivo para la diseminación metastásica.
El trabajo, publicado en la revista Nature Communications, combina análisis de secuenciación de ARN de célula única (scRNA-seq) con experimentos in vitro para estudiar cómo varían los diferentes tipos de células endoteliales linfáticas (LEC) en los ganglios linfáticos metastásicos de pacientes con cáncer de mama. Los resultados revelan que la heterogeneidad de estas células es mucho mayor de lo estimado previamente y, lo más importante, que el cáncer provoca una transformación profunda en su composición, función y comportamiento.
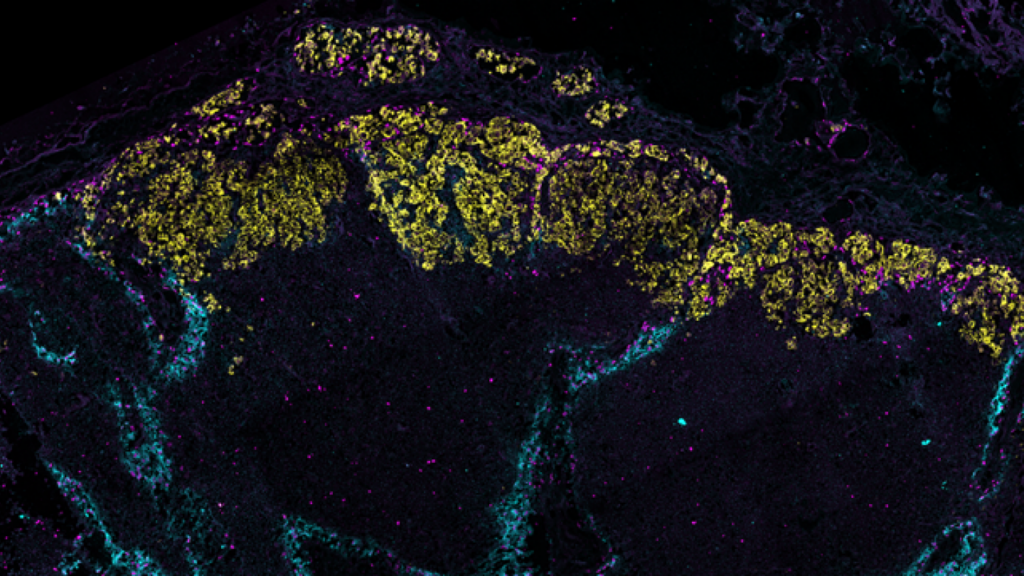 La imagen muestra un ganglio linfático con células cancerosas marcadas en amarillo. Las venas azules son vasos linfáticos / Universidad de Turku.
La imagen muestra un ganglio linfático con células cancerosas marcadas en amarillo. Las venas azules son vasos linfáticos / Universidad de Turku.
Un sistema linfático que cambia bajo la presión del tumor
En condiciones normales, los vasos linfáticos actúan como autopistas del sistema inmunitario: transportan antígenos y células de defensa hacia los ganglios linfáticos, donde se inicia la respuesta inmune. Pero este mecanismo vital puede ser subvertido por las células cancerosas.
Estudios previos ya habían demostrado que los tumores inducen linfangiogénesis, es decir, la formación de nuevos vasos linfáticos mediante factores como VEGF-C y VEGF-D, lo que facilita su llegada a los ganglios linfáticos. Sin embargo, la nueva investigación revela un nivel de sofisticación aún mayor: el tumor reprograma a los subconjuntos de células linfáticas dentro de los propios ganglios centinela.
Gracias a la secuenciación unicelular de muestras pareadas —ganglios metastásicos y no metastásicos del mismo paciente— los investigadores detectaron alteraciones drásticas en grupos específicos de LEC. Por ejemplo, se observó una pérdida de las LEC del suelo del seno subcapsular (SCS) y de las LEC del seno medular, ambas poblaciones clave en la vigilancia inmunitaria. Estas células expresan moléculas implicadas en inflamación y defensa del organismo, incluida la proteína inhibitoria PD-L1, esencial en la regulación de la actividad de los linfocitos T.
Su desaparición podría tener consecuencias importantes: un ganglio linfático que pierde estos subconjuntos defensivos se vuelve un entorno más permisivo para la implantación y supervivencia de células tumorales.
Al mismo tiempo, los investigadores detectaron la aparición de subconjuntos anormales de LEC, especialmente las denominadas CD200+HEY1+, que no habían sido caracterizadas anteriormente y que aparecían de forma consistente en distintos pacientes. Estas células, según sugieren los análisis de trayectoria, derivan de un subconjunto basal del techo del seno subcapsular, pero se transforman bajo la influencia de la metástasis. Su expansión parece mejorar la capacidad de las células cancerosas para abandonar los ganglios linfáticos y continuar su recorrido metastásico.
MGP: «pegamento» entre el cáncer y los vasos linfáticos
Uno de los hallazgos más relevantes del estudio es la identificación de la proteína Matrix Gla (MGP) como un factor clave en la interacción entre células tumorales y vasos linfáticos. La MGP estaba drásticamente sobreexpresada en todos los subconjuntos de LEC de los ganglios metastásicos analizados, pero ausente en los ganglios no afectados del mismo paciente. Este patrón contundente sugiere que el tumor induce directamente su producción.
Aunque la MGP era conocida por su papel en la formación ósea y en la regulación de la calcificación vascular, su función en los vasos linfáticos era prácticamente desconocida. El equipo demostró, mediante experimentos de cocultivo, que las células de cáncer de mama liberan factores—como VEGF-A, VEGF-C y TGF-β— capaces de activar la expresión de MGP en las células LEC.
Los experimentos funcionales revelaron datos sorprendentes, según los autores: cuando la MGP se silenciaba, las células linfáticas aumentaban su migración, mientras que la adhesión de células cancerosas a los LEC disminuía notablemente. Estos indica que la MGP actúa como una especie de «adhesivo» molecular, favoreciendo que las células cancerosas se anclen a los vasos linfáticos, lo que podría facilitar su expansión.
Asimismo, los experimentos funcionales revelaron datos sorprendentes: cuando la MGP se silenciaba, las células linfáticas aumentaban su migración, mientras que la adhesión de células cancerosas a los LEC disminuía notablemente. Esto indica que la MGP actúa como una especie de adhesivo molecular, favoreciendo que las células cancerosas se anclen a los vasos linfáticos, lo que podría facilitar su expansión.
Este comportamiento coincide con estudios previos en otros tumores, como el osteosarcoma, donde la MGP también incrementa la capacidad de las células cancerosas para adherirse a las células endoteliales.
Un sistema inmunitario desarmado
Más allá de la transformación estructural, los investigadores sostienen que estos cambios alteran la manera en que los vasos linfáticos interactúan con el sistema inmunitario. Las LEC no son simples conductos: también presentan antígenos y regulan la activación de linfocitos, pudiendo incluso inducir tolerancia inmunológica.
Si los subconjuntos de LEC que expresan PD-L1 —entre ellos los del suelo del SCS y el seno medular— disminuyen, y en su lugar emergen grupos sin esta molécula, el equilibrio inmunitario podría inclinarse hacia un estado más permisivo para el tumor. Este hallazgo podría tener implicaciones para la eficacia de terapias inmunológicas como los inhibidores de PD-L1 (atezolizumab, durvalumab), cuyo rendimiento podría verse afectado por la composición del microambiente linfático.
Aunque la cohorte analizada en el estudio es limitada y los tiempos de seguimiento aún son cortos, los investigadores destacan que los cambios observados reflejan un proceso fundamental en la progresión del cáncer de mama. La posibilidad de que moléculas como la MGP o los factores que la regulan actúen como dianas terapéuticas es especialmente prometedora.
«Estos resultados revelan una nueva perspectiva sobre por qué se propaga el cáncer de mama y por qué es difícil detenerlo», afirmó Sirpa Jalkanen, directora del consorcio InFLAMES. «Al comprender mejor cómo el cáncer altera los vasos linfáticos, podemos desarrollar terapias dirigidas que prevengan este proceso y mejoren los resultados de las pacientes en el futuro».
También te puede interesar…