La detección del cáncer de mama es una intervención vital de salud pública que permite la identificación temprana de lesiones malignas mejorando así de forma significativa los resultados del tratamiento y reduciendo la mortalidad. La detección precoz mediante programas de cribado posibilita la aplicación de modalidades terapéuticas menos invasivas y más eficaces, lo que en última instancia se traduce en mayor sobrevida de las pacientes.[1]
Como forma de prevención secundaria, el cribado del cáncer de mama desempeña un papel central en la reducción de la gravedad de la enfermedad en el momento de la presentación y en la disminución de la morbilidad asociada al tratamiento. Las estrategias de detección precoz aseguran que los cánceres se identifiquen cuando son más sensibles al tratamiento, minimizando la necesidad de intervenciones quirúrgicas extensas y terapias adyuvantes y contribuyendo a reducir las cargas psicológicas y económicas que enfrentan las pacientes y sus familias.[2]
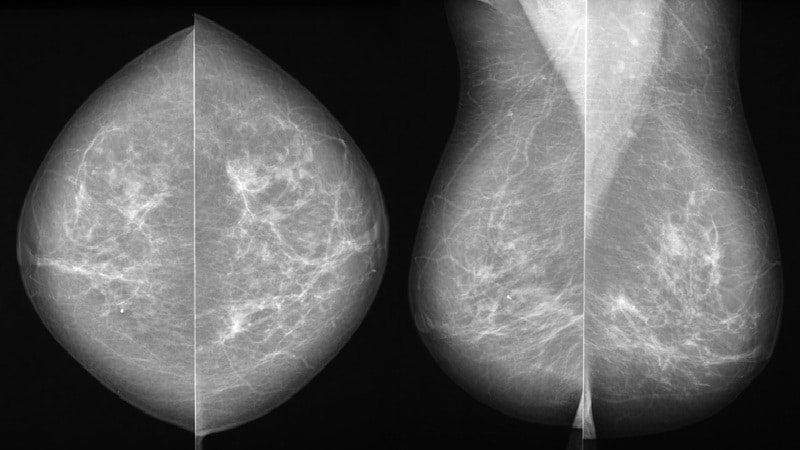
La mamografía sigue siendo la piedra angular del cribado del cáncer de mama, ya que ofrece una técnica de imagen fiable y ampliamente disponible capaz de detectar cambios patológicos tempranos en el tejido mamario. Los avances en la mamografía digital han mejorado la calidad de la imagen, incrementando así la sensibilidad y la precisión diagnóstica. Técnicas complementarias, como la ecografía y la resonancia magnética, suelen emplearse, especialmente en mujeres con mama densa, para sortear limitaciones inherentes. Las guías de cribado generalmente recomiendan que las mujeres dentro de determinado rango de edad se sometan a mamografías con regularidad, con la frecuencia adaptada según factores de riesgo individuales y las políticas sanitarias nacionales.[3]
Las tendencias epidemiológicas globales indican que la adopción de programas de cribado bien organizados ha conducido a variaciones significativas en la mortalidad por cáncer de mama entre distintas regiones. Los países que implementaron con éxito iniciativas regulares de cribado observan mejoras medibles en las tasas de detección precoz, que a su vez se traducen en mejores resultados de sobrevida. No obstante, varios países, incluida España, continúan experimentando retrasos en el proceso diagnóstico.[4]
¿Cuándo debe el riesgo, y no la rutina, guiar su estrategia de cribado? ¿Qué confianza tiene cuando la mamografía se enfrenta a la incertidumbre? ¿La nueva imagen mejora los resultados o solo cambia el papeleo? Evalúe sus conocimientos con nuestro mini-examen clínico.
Las mamas extremadamente densas representan un desafío notable porque la densidad radiográfica reduce significativamente el contraste entre las lesiones y el tejido fibroglandular normal, no solo contribuyendo a mayor riesgo de cáncer, sino también comprometiendo la sensibilidad y especificidad de la mamografía de cribado. Estudios recientes enfatizan que el efecto de enmascaramiento del tejido denso puede conducir a un diagnóstico retrasado y a resultados falsos negativos, lo que afecta negativamente los desenlaces clínicos. Surge un reto clínico al equilibrar los beneficios de la sensibilidad adicional que aportan las imágenes suplementarias con el potencial aumento de falsos positivos que pueden conducir a procedimientos innecesarios.[5,6]
A pesar de estos retos, las principales organizaciones abogan por la mamografía de cribado como la modalidad de primera línea para la detección del cáncer de mama. Modalidades de imagen suplementaria como la resonancia magnética y la mamografía con contraste han emergido como estrategias para mejorar la detección en mujeres con mamas extremadamente densas; sin embargo, aunque estas técnicas ofrecen mayor sensibilidad en comparación con la mamografía estándar, también introducen inconvenientes, incluidos mayores índices de falsos positivos que pueden resultar en biopsias innecesarias y un incremento de la ansiedad de las pacientes. Si bien la imagen suplementaria puede ser beneficiosa, su uso sistemático en mujeres de riesgo promedio con mamas densas no está universalmente recomendado.[7]
Las recomendaciones sugieren que la imagen suplementaria debe reservarse para pacientes cuyo perfil de riesgo indique mayor probabilidad de enfermedad no diagnosticada. Una declaración reciente aclara que la Comisión de Servicios Preventivos de Estados Unidos (USPSTF) considera que la evidencia es insuficiente para determinar el beneficio neto de modalidades de imagen suplementaria como la ecografía mamaria o la resonancia magnética además de la mamografía en mujeres de riesgo promedio. Su análisis refleja preocupaciones sobre el equilibrio entre beneficios y daños, señalando que, aunque el cribado suplementario puede mejorar la detección en mamas densas, también conduce a un aumento de resultados falsos positivos y a la posibilidad de sobrediagnóstico.[8]
Para más información sobre cribado del cáncer de mama, lea aquí.
Evidencia reciente de un gran estudio de cohorte indicó que, al comparar el cribado con tomosíntesis digital de mama frente a mamografía digital estándar 2‑D se observó un modesto aumento en la detección de cáncer, pero no se demostró reducción consistente de los cánceres invasivos de intervalos. El estudio reportó que se detectaron cánceres adicionales a una tasa del orden de aproximadamente 0,5 a 1,5 por cada 1.000 cribados, beneficio incremental que puede ser estadísticamente significativo pero cuyo impacto clínico aún debe elucidarse por completo. En sus análisis los investigadores también señalaron que las tasas de repetición fueron significativamente menores con tomosíntesis digital de mama, lo que sugiere que la imagen tridimensional reduce los falsos positivos.[9,10]
Una de las ventajas más citadas de la tomosíntesis digital de mama en estudios comparativos es su capacidad para reducir las tasas de repetición respecto a la mamografía digital estándar 2‑D, lo que se traduce en menos mujeres sometidas a investigaciones diagnósticas adicionales. La mejor detección de lesiones ofrecida por tomosíntesis digital de mama minimiza la cantidad de hallazgos ambiguos que conducen a repeticiones, agilizando así el proceso de cribado y reduciendo las cargas psicológicas y económicas asociadas a los resultados falsos positivos. En muchas series, la reducción de repeticiones está bien documentada, lo cual es una consideración importante para el cribado poblacional donde las tasas altas de repetición pueden provocar tensión en los recursos y malestar en las pacientes. La reducción de repeticiones también puede contribuir a mejora en la relación costo‑efectividad de los programas de cribado al disminuir procedimientos de seguimiento innecesarios.[5]
Estos hallazgos son críticos porque los cánceres de intervalo—aquellos diagnosticados entre exámenes de cribado programados— suelen ser más agresivos y tienen mayor impacto en los desenlaces de las pacientes. A pesar de las mejoras en las tasas de detección observadas en las pruebas de cribado, la falta de reducción en las tasas de cánceres de intervalo plantea dudas acerca de que la mayor sensibilidad de la tomosíntesis digital de mama se traduzca realmente en beneficio clínico superior. Además, el aumento marginal en la detección de cáncer podría verse contrarrestado por el riesgo de sobrediagnóstico, es decir, la detección y tratamiento de cánceres que nunca habrían causado problemas clínicos. En consecuencia, aunque la tomosíntesis digital de mama ofrece mejoras tecnológicas, sus beneficios prácticos en términos de reducción de enfermedad avanzada siguen siendo inconclusos.[11]
Para más información sobre cribado del cáncer de mama, lea aquí.
En comparación con otros modelos de riesgo establecidos como IBIS o Tyrer‑Cuzick y BRCAPRO, BOADICEA se distingue por incluir explícitamente el historial familiar multigeneracional, lo que le permite capturar patrones de herencia complejos y el agrupamiento familiar que pueden no modelarse adecuadamente con algoritmos más simples. La capacidad de modelar relaciones familiares detalladas, incluyendo tanto parientes de primer grado como más lejanos, posibilita evaluaciones precisas de la probabilidad de mutación, lo que lo hace esencial en escenarios de riesgo familiar.[12,13]
La fortaleza de BOADICEA radica en su capacidad para integrar datos multigeneracionales cruciales para comprender el componente hereditario del riesgo de cáncer de mama. Al tener en cuenta sistemáticamente la edad, el estado de cáncer y las probabilidades de portador de mutaciones a través de generaciones, BOADICEA proporciona estimaciones dinámicas que se ajustan al agrupamiento familiar. Modelar explícitamente toda la estructura familiar permite diferenciar entre patrones de enfermedad esporádica y familiar, lo cual es vital para orientar las pruebas genéticas y las intervenciones de reducción de riesgo.[14]
Otro aspecto fundamental que distingue a BOADICEA es la incorporación de variantes patogénicas raras presentes en genes de alto y moderado riesgo como BRCA1, BRCA2, PALB2, CHEK2, ATM, RAD51C y RAD51D. Incluir estas variantes raras proporciona estimaciones directas de probabilidad de mutación, esenciales para adaptar estrategias de prevención y tratamiento. En contraste con modelos que se basan únicamente en variantes comunes o factores no genéticos, la capacidad de BOADICEA para integrar mutaciones raras de alto impacto genera estimaciones de riesgo que reflejan mejor el riesgo genético verdadero de un individuo.[15]
Finalmente, la integración de puntuaciones de riesgo poligénico en BOADICEA representa un avance importante en la modelización del riesgo, al captar los efectos acumulativos de numerosas variantes genéticas comunes que individualmente contribuyen un riesgo modesto pero que colectivamente tienen un impacto sustancial. De este modo, el modelo refina las estimaciones de riesgo más allá de lo que puede derivarse solo de las variantes raras, ofreciendo evaluaciones de riesgo más personalizadas. Este enfoque dual cierra la brecha entre el análisis de mutaciones de alta penetrancia y las influencias genéticas más amplias, mejorando la precisión discriminativa, particularmente entre individuos con riesgo familiar no sindrómico. Como resultado, BOADICEA ofrece una evaluación integral del riesgo que integra tanto contribuciones genéticas raras como comunes, optimizando la estratificación del riesgo para la toma de decisiones clínicas.[16]
Para más información sobre cribado del cáncer de mama, lea aquí.
El consenso entre múltiples organizaciones profesionales, incluidas las representadas en publicaciones recientes, es que la mamografía de vigilancia anual constituye la piedra angular del seguimiento en mujeres con antecedente personal de cáncer de mama. Esta recomendación se basa en gran medida en el consenso de expertos más que en evidencia procedente de ensayos aleatorizados controlados, pero sigue siendo el estándar establecido de atención.[17,18]
Además de establecer una línea base, la mamografía de vigilancia inicial realizada entre los 6 y 12 meses posteriores a la radioterapia es crítica para diferenciar los cambios posterapéuticos benignos de una posible enfermedad recurrente. Este intervalo se recomienda para permitir la disipación de los cambios inducidos por el tratamiento, que podrían enmascarar una patología subyacente si la imagen se realizara demasiado pronto. Las investigaciones han demostrado que la adherencia a un intervalo de imagen anual, típicamente iniciado dentro del primer año tras completar el tratamiento, es indicativa de una atención acorde con las guías en una cohorte de sobrevivientes de cáncer de mama.[19]
Es importante reconocer que aunque la mamografía de vigilancia rutinaria está ampliamente recomendada, la base de evidencia respecto a su beneficio en mortalidad descansa en gran medida en datos observacionales y en guías de consenso. La justificación para la imagen anual se fundamenta en la suposición clínica de que la detección más temprana de recurrencias locales o de nuevos primarios conduce lógicamente a mejores resultados. Las guías clínicas actuales enfatizan la importancia de establecer una línea base de imagen reproducible y de mantener una vigilancia anual consistente a partir de entonces.[20]
Para más información sobre cribado del cáncer de mama, lea aquí.
En múltiples estudios del mundo real y estudios prospectivos, la interpretación asistida por inteligencia artificial de las mamografías ha demostrado aumentar las tasas de detección de cáncer. Por ejemplo, un estudio retrospectivo multicéntrico mostró que el uso de esta tecnología en una población de cribado completa mejoró la precisión de la detección en comparación con los métodos convencionales. Estos estudios informan ganancias incrementales en la detección de cáncer, típicamente cuantificadas como mejoras modestas por cada 1.000 cribados, que aunque pequeñas en números absolutos, pueden traducirse en importantes beneficios de salud pública cuando se escalan a grandes poblaciones.[21,22]
Junto al aumento de las tasas de detección, los sistemas asistidos por inteligencia artificial han mostrado reducir las tasas de repetición y mitigar la carga de trabajo del radiólogo. Varios estudios retrospectivos han informado que cuando dicha tecnología se utiliza como lector secundario o como lector independiente, las repeticiones y falsos positivos se reducen de forma significativa. Estas reducciones no solo disminuyen la ansiedad de las pacientes y las exploraciones de seguimiento innecesarias, sino que también optimizan la eficiencia del flujo de trabajo al permitir que los radiólogos se concentren en los casos realmente complejos. La disminución de la carga de trabajo puede contribuir a ahorro de costos y a mayor sostenibilidad de los programas de cribado en un momento en que la disponibilidad de radiólogos está sometida a presión.[23]
A pesar de estos hallazgos alentadores, hasta la fecha los ensayos aleatorizados controlados de alta calidad no han demostrado de forma consistente un beneficio de mortalidad derivado del cribado con apoyo de inteligencia artificial. La integración clínica cuidadosa de la herramienta requiere no solo la confirmación de mejoras en los resultados de detección, sino también atención minuciosa a los parámetros operativos de su implementación. Los estudios de validación han subrayado la necesidad de una selección cuidadosa de umbrales para equilibrar sensibilidad y especificidad. Además, la integración en la práctica clínica exige marcos de gobernanza que aseguren el monitoreo continuo del rendimiento de la inteligencia artificial, aborden sesgos potenciales y establezcan protocolos de recalibración a lo largo del tiempo.[24]
Para más información sobre cribado del cáncer de mama, lea aquí.
El Dr. Hermano Alexandre Lima Rocha es médico, becario posdoctoral en epidemiología en la Harvard School of Public Health, exalumno del curso Effective Writing for Health Care de la Harvard Medical School y profesor de epidemiología en la Facultad de Medicina de la Universidade Federal do Ceará en Brasil. También es científico del desarrollo infantil, realiza estudios epidemiológicos para la generación de políticas públicas que ayuden a aumentar el capital humano internacional y desarrolla investigaciones en estadística específica de inteligencia artificial con uso aplicado en salud pública.