Brittiläisen University College London -yliopiston ja Itä-Suomen yliopiston Kuopion kampuksen yhteinen tutkimus on saanut selville, että jopa yli 90 prosenttia Alzheimerin taudin tapauksista länsimaissa ei puhkeaisi ilman yhden geenin vaikutusta.
Kolmen brittitutkijan ja kahden suomalaistutkijan ryhmä pani merkille myös sen, että lähes puolet kaikista dementiasairaustapauksista ei todennäköisesti puhkeaisi ilman samaisen geenin vaikutusta.
Nature Partner Journals: Dementia -tiedejulkaisussa tammikuun 9. päivänä julkaistuun tutkimukseen antoivat panoksensa Itä-Suomen yliopiston Kuopion kampuksen biolääketieteen yksikön kudos- ja solubiologian professori Mikko Hiltunen sekä tutkimusjohtaja Sami Heikkinen.
Tutkimus tarkasteli yhteensä 460 255 yli 60-vuotiaan ihmisen perimää ja terveystietoja. Suomalaisosuus kokonaisuudesta oli 289 150 ihmistä ja brittiosuus 171 105 ihmistä. Tutkijat keräsivät datakokonaisuuden neljästä eri tutkimuksesta. Suomalaisia koskevan datan tutkijat saivat käyttöönsä FinnGen-tutkimushankkeesta.
Tutkimuksen keskiössä oli APOE-geeni, joka koodaa rasva-aineenvaihduntaan osallistuvaa apolipoproteiini E:tä (ApoE).
APOE-geenistä esiintyy kolmea alleelimuotoa eli varianttia ja niiden kuutta eri yhdistelmää esiintyy sen mukaan, mitä vanhemmilta peritään.
”APOE-geenistä esiintyy kolme pääasiallista alleelimuotoa, epsilon‑2 (ε2), epsilon‑3 (ε3) ja epsilon‑4 (ε4)”, Hiltunen kertoo.
”Genotyyppiyhdistelmät ovat puolestaan ε2/ε2, ε2/ε3, ε2/ε4, ε3/ε3, ε3/ε4 sekä ε4/ε4”, hän tarkentaa.
Geenitutkijat havaitsivat jo 1990-luvun alussa, että ihmisillä, joiden perimässä esiintyy APOE‑geenin ε4‑alleeli ja etenkin homotsygoottina eli samaperintäisenä kahden ε4‑kopion yhdistelmä, on merkittävästi kohonnut riski sairastua Alzheimerin tautiin verrattuna ε2‑ ja ε3‑alleelien kantajiin.
Samalla tutkijat havaitsivat, että pienin sairastumisriski on APOE ε2:n kantajilla.
Yhdistelmistä harvinaisimmat ovat ε2/ε2 ja ε4/ε4. Ensimmäinen on siis yhteydessä matalimpaan Alzheimerin taudin sairastumisriskiin ja toinen korkeimpaan.
Aiemmat tutkimukset ovat yhdistäneet ε4‑alleelin kohonneeseen Alzheimerin taudin riskiin, koska sen tuottaman ApoE4‑proteiinimuodon on osoitettu kytkeytyvän lisääntyneeseen beeta-amyloidipeptidin kertymiseen beeta-amyloidiplakeiksi aivokudoksessa.
”Tämä plakki on siis iän myötä aivoihin kertyvää kuona-ainetta, joka toimii ikään kuin Alzheimerin alkusiemenenä”, Hiltunen kuvailee.
”Yksi selkeimmistä merkeistä, joka on noussut esiin sekä tässä että aiemmissa tutkimuksissa, on havainto kuolemanjälkeisistä aivonäytteistä: henkilöillä, joilla on erityisesti APOE ε4‑alleelimuoto, todetaan johdonmukaisesti enemmän beeta-amyloidikertymiä aivokudoksessa”, Hiltunen sanoo.
Tutkimus, jossa Hiltunen ja Heikkinen olivat nyt mukana, paljasti, että myös APOE ε3 alleeli lisää sairastumisriskiä merkittävästi.
”Olemme pitkään aliarvioineet APOE-geenin osuuden Alzheimerin puhkeamisessa. Geenin ε4-muoto tunnetaan jo entuudestaan riskitekijänä, mutta suuri osa tapauksista ei esiintyisi ilman ε3-muodon tuomaa lisävaikutusta. Muoto on tulkittu tähän asti väärin neutraalina osasena riskitekijöiden joukossa. Jos katsomme ε3- ja ε4-muotojen osuutta, näemme, että näillä on rooli lähes kaikissa Alzheimer-tapauksissa. Jos tietäisimme, miten vähentää riskiä sen osalta, että ihmiselle periytyy ε3- ja ε4-yhdistelmiä, kykenisimme ehkä estämään suurimman osan Alzheimer-tapauksista”, kertoo tutkimusta johtanut University College London -yliopiston tohtori Dylan Williams yliopiston tiedotteessa.
Williams, Hiltunen ja Heikkinen eivät siis vielä tammikuisessa tutkimuksessaan saaneet selville biologisia mekanismeja sen taustalla, miksi ja miten APOE ε3 lisää Alzheimerin sairastumisriskiä niin merkittävästi ε2-muodon matalaan riskiin nähden.
Se saatiin kuitenkin selville, kuinka paljon ε3- ja ε4-muodot vaikuttavat riskiin.
Yhteensä 460 255 ihmisen perimää käsittelevä tutkimusdata mahdollisti sen, että mukaan saatiin myös riittävän paljon harvinaisempaa APOE ε2/ε2-yhdistelmää kantavia ihmisiä. Heitä käytettiin riskianalyysin matalariskisenä vertailuryhmänä.
Analyysin arvio on lievästi sanottuna karu: 72-93 prosenttia tarkastellun ihmisryhmän Alzheimer-tapauksista ei olisi koskaan puhjennut ainakaan nykyisessä muodossaan, jos APOE-geenin ε3‑alleeleja ja erityisesti ε4‑alleeleja ei olisi ollut perimässä. Dementiaa aiheuttavia sairauksia kokonaisuutena tarkastellen vastaava luku oli 45 prosenttia.
Luvut ovat aiempien tutkimusten esittämiin arvioihin verrattuna selvästi korkeammat pääosin siksi, että APOE ε3-alleelin roolia ei ole huomioitu niissä ε4:n lisäksi.
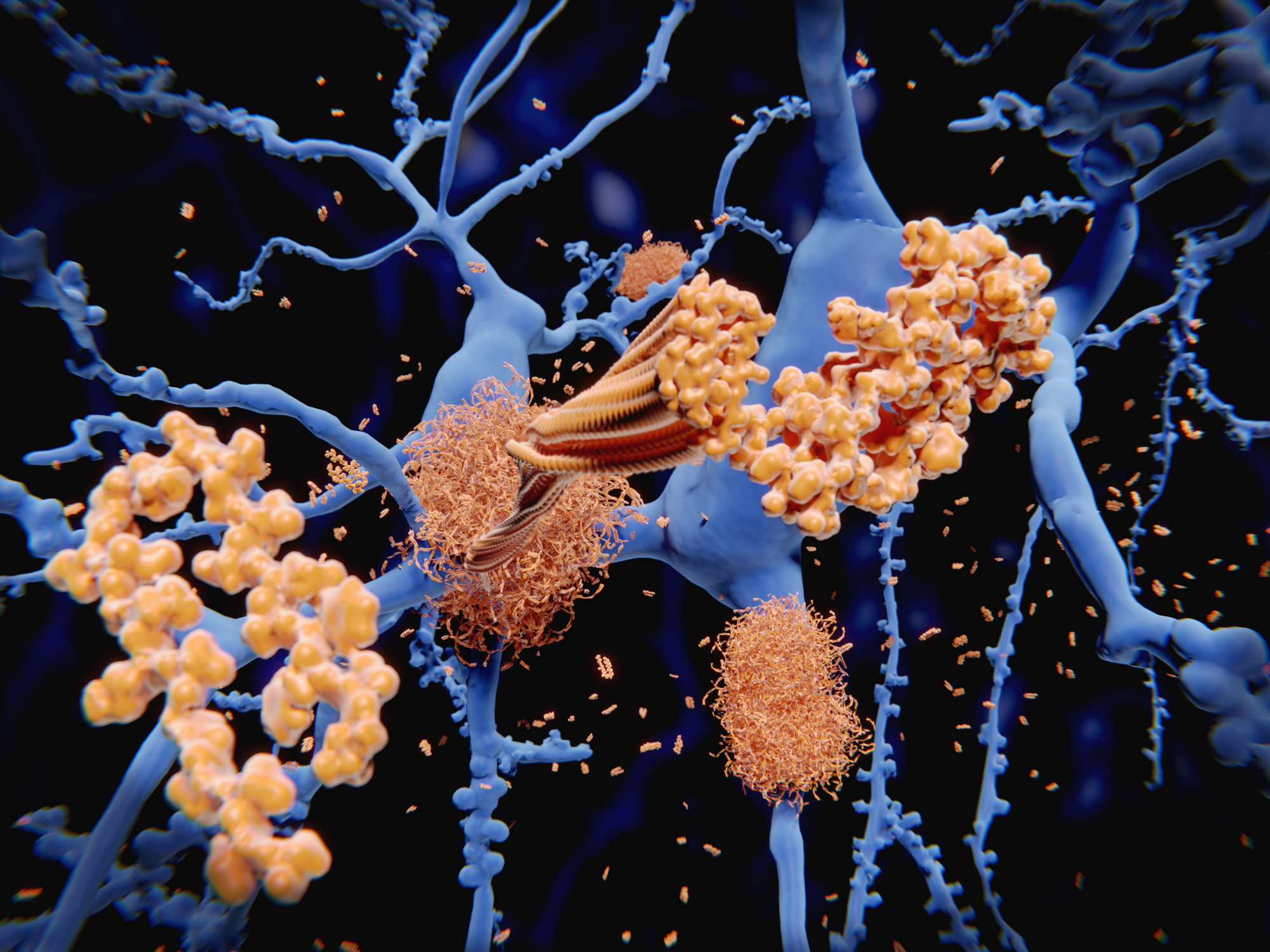 Kuvituskuvassa aivoihin muodostuu amyloidiplakkeja, Alzheimerin taudin tunnusomaisia piirteitä. Pilkkoutuneen amyloidiproteiinin osaset (beeta-amyloidipeptidit, kellertäviä) sakkautuvat ja kertyvät amyloidiplakeiksi hermosolujen (sinisiä) väleihin.
Kuvituskuvassa aivoihin muodostuu amyloidiplakkeja, Alzheimerin taudin tunnusomaisia piirteitä. Pilkkoutuneen amyloidiproteiinin osaset (beeta-amyloidipeptidit, kellertäviä) sakkautuvat ja kertyvät amyloidiplakeiksi hermosolujen (sinisiä) väleihin.
Istock
Tutkimuksen päähavainto on se, että APOE-geenivariantit ovat todennäköisesti jossain määrin vastuussa ainakin kolmessa neljästä Alzheimer-tapauksesta.
Taudin kehittymiseen vaikuttavat toki muutkin geneettiset ja ympäristölliset tekijät APOE:n rinnalla, mutta geenin rooli on kokonaisuutta tarkastellen silti vahva, tutkimus antaa ymmärtää.
Tutkimuksen pääviesti on puolestaan se, että APOE-geeniä ei voida enää sivuuttaa tutkimuksessa, jonka tavoitteena on kehittää esimerkiksi kohdennettua lääkehoitoa Alzheimerin taudille ja muille dementiasairauksille.
Sen rooli on tutkijoiden mukaan niin merkittävä sairauden kehittymisessä, että sitä pitäisi priorisoida.
”Geenimuokkauksessa ja muissa geeniterapian muodoissa, jotka kohdistuvat suoraan geneettisiin riskitekijöihin, on otettu viime vuosina suuria kehitysharppauksia. Kohdistamalla menetelmiä suoraan APOE-geeniin tai molekyylitason polkuun geenin ja sairauden välillä, voisimme mahdollisesti ehkäistä tai hoitaa suurimman osan Alzheimerin taudin tapauksista”, Williams hahmottelee tiedotteessa.
Hän kuitenkin rauhoittelee geenin haitallisia muotoja kantavia ihmisiä.
”Suurin osa APOE-geenin ε3- ja ε4- alleelikantajista ei sairastu dementiaan elämänsä aikana, koska muidenkin geneettisten ja ympäristöön nojaavien riskitekijöiden välillä on monimutkaisia vuorovaikutuksia. Seuraava tärkeä asia, joka dementiatutkijoilla on selvitettävänään, on se, mikä määrittelee sairastumisriskin, jonka ihmiset perivät APOE-geeneistään”, Williams muotoilee.
Voidaanko nyt siis sanoa, että sota Alzheimerin tautia vastaan alkaisi vihdoinkin lähestyä loppuaan?
Hiltusen mukaan näin ei voida vielä missään nimessä todeta.
”APOE:n rooli Alzheimerin taudin riskitekijänä on tunnettu jo 1990‑luvulta lähtien, jolloin havaittiin, että APOE:n ε4‑alleeli nelinkertaistaa sairastumisriskin. Tässä mielessä tutkimuksemme ei tuonut uutta tietoa itse riskivaikutuksen olemassaolosta, vaan pikemminkin vahvisti sen voimakkuuden: kun vertaamme tilannetta, jossa riskivaikutusta ei ole lainkaan, eli ε2‑alleelin kantajia verrattuna henkilöihin, joilla on ε4‑alleeli, ero korostaa poikkeuksellisen selvästi APOE:n merkitystä Alzheimerin taudissa. Tutkimuksemme siis tarkentaa entisestään käsitystä siitä, kuinka keskeinen ja voimakkaasti vaikuttava tekijä APOE on koko taudinkuvassa”, Hiltunen kuvailee.
Miksi APOE-geenin ε3-alleelin roolia on aliarvioitu sairauden kehittymisessä aiemmissa tutkimuksissa?
”APOE ε4 on keskeisin tekijä, mutta ε3 on ollut tässä kokonaisuudessa aiemminkin tavallaan mukana. Sen taustalla näyttelevää tarkempaa biologista tautimekanismia ei olla kuitenkaan pystytty täysin selvittämään, eikä sen lopullinen rooli ole siis tiedossa”, hän perustelee.
”APOE ε4:n roolista on tullut jonkin verran uutta tietoa viime aikoina, mutta senkin biologia on vielä yksityiskohtaisesti selvittämättä. Yksi keskeinen huomio on, että APOE‑geenin koodaama ApoE osallistuu voimakkaasti rasva‑ ja kolesteroliaineenvaihduntaan, joten juuri näistä aineenvaihduntareiteistä voi löytyä vielä lisävihjeitä. Taustalla saattaa siis olla useita erilaisia biologisia mekanismeja, jotka ovat yhteydessä APOE ε3- ja ε4-muotojen riskiin, ja niitä tulisi nyt ehdottomasti selvittää tarkemmin tulevissa tutkimuksissa”, Hiltunen jatkaa.
 Itä-Suomen yliopiston Kuopion kampuksen biolääketieteen yksikön kudos- ja solubiologian professori Mikko Hiltunen.
Itä-Suomen yliopiston Kuopion kampuksen biolääketieteen yksikön kudos- ja solubiologian professori Mikko Hiltunen.
Itä-Suomen yliopisto, UEF
Mistä johtuu sitten se, että sairauden kannalta näinkin merkittävä geeni kuin APOE on jäänyt valitettavan pienelle huomiolle lääkekehityksessä ja hoitokeinoja kartoittavissa tutkimuksissa?
”Se johtuu yksinkertaisesti siitä, että eri APOE-muotojen tarkkaa roolia Alzheimerissa ei ole pystytty selvittämään. Jotta kohdennettu hoitomuoto pystyttäisiin kehittämään, tarvitaan ensin tarkka ymmärrys niistä solutason mekanismeista, joita meillä ei nyt ole. Emme siis vielä tiedä, mihin mahdollinen terapia pitäisi kohdentaa geenivarianttien ja sairauden välisellä biologisella reitillä. Voisiko esimerkiksi kolesteroliaineenvaihduntaan vaikuttaminen olla hyödyllistä? Se on yksi todennäköinen suunta, mutta varmuutta ei vielä ole. Tämä tutkimus, yhdessä aiempien tutkimusten kanssa, osoittaa kuitenkin selvästi, että APOE‑geenivarianttien tutkimukseen on perusteltua kohdentaa entistä enemmän resursseja”, Hiltunen arvioi.
Missä vaiheessa geenimuokkaukseen ja geenien hiljentämiseen perustuvat menetelmät voisivat olla kliinisen soveltamisen näkökulmasta käyttökelpoisia APOE-geenin kohdalla? Onko APOE geenin ε3- ja ε4-muodoista ihmiselle lopulta mitään hyötyä?
”Meillä on toki jo olemassa tehokkaita geenimuokkausmenetelmiä, mutta ennen kuin ymmärrämme, millaiset biologiset mekanismit vaikuttavat APOE‑geenin eri varianttien taustalla, ei näitä menetelmiä voida vielä turvallisesti tai tarkoituksenmukaisesti soveltaa. On myös hyvä muistaa, että luonto ei yleensä ylläpidä mitään täysin turhaa. APOE ε4 ‑muodolla saattaa siis olla, tai on aiemmin ollut jokin hyödyllinen fysiologinen rooli tietyissä olosuhteissa. On esitetty esimerkiksi, että menneiden vuosisatojen 30-50‑vuotiailla APOE ε4‑alleelin kantajilla olisi ollut kyky hyödyntää ravinnosta saatavia rasvoja tavallista tehokkaammin energianlähteenä. Toisin sanoen APOE ε4 muoto on voinut tehostaa rasva‑aineenvaihduntaa. Kun ihmisten keskimääräinen elinikä on sittemmin merkittävästi pidentynyt, tämä aiemmin hyödyllinen selviytymisominaisuus on nyt kääntynyt haitalliseksi”, Hiltunen pohtii.
Puhuttaessa geenien muokkaamisesta, hän ottaa esiin eettisen puolen.
”Jos ajatellaan eettisesti tätä tilannetta, niin näkisin, että tämä on erittäin vaikea kysymys. Emme ole kovinkaan monen sairauden kohdalla vielä päässeet pisteeseen, että lähtisimme muokkaamaan perinnöllisiä tekijöitä näin voimakkaasti. Alzheimerin taudin kohdalla olisin erittäin varovainen vielä geenimuokkauksen suhteen. Jos kohdennamme tulevaisuudessa lääketerapiamenetelmiä, niin niitä pitäisi kohdentaa etenkin APOE ε4-muotojen kantajiin. APOE ε3-kantajien geeneihin en lähtisi koskemaan”, hän painottaa.
Tuloksista saa sellaisen kuvan, että jos kaikilla olisi perimässään luonnostaan harvinainen APOE ε2/ε2-yhdistelmä, ilmenisi Alzheimerin tautia vain vähän. Olisiko tällaiseen tilanteeseen mahdollista päästä?
”On tärkeää huomioida, että jos kaikilla olisi molemmilta vanhemmilta peritty APOE ε2/ε2 -yhdistelmä, se aiheuttaisi omat ongelmansa. Kyseinen yhdistelmä altistaa tyypin 3 hyperlipoproteinemialle, joka johtaa rasvankuljetusjäämien heikentyneeseen poistoon verestä. Toisin sanoen tämäkin yhdistelmä voi johtaa omaan sairauteensa, eikä sitä voida missään nimessä pitää tavoiteltavana tilana”, Hiltunen korostaa.
Miksi suurin osa geenin haitallisia muotoja kantavista ei sairastu elinaikanaan?
”Jos ajattelemme geneettistä puolta, siis yksilöitä, ovat APOE-geenin ε3- ja ε4-alleelimuodot riskitekijöitä. Eivät siis suoraan kausatiivisia eli tautia aiheuttavia. Jos on perinyt molemmilta vanhemmiltaan kuitenkin APOE ε4-muodon, eli on APOE ε4/ε4 -homotsygootti, samaperintäinen, on riski sairastua Alzheimeriin 16-kertainen eli lähes kausatiivinen. Tällaisia tapauksia on onneksi kuitenkin suhteellisen vähän. Näissä tapauksissa henkilöillä on usein myös kasvanut riski sairastua johonkin muuhun vakavaan sairauteen 40–60 ikävuoden tienoilla. Sydän- ja verisuonitaudit ja aivoverenkiertohäiriöt ovat tässä tapauksessa yleisiä. Juurisyy piilee rasva-aineenvaihdunnan muutoksissa, eli lipidien ja kolesterolin kertymisessä verisuoniin”, Hiltunen kertoo.
Suomeen on pian tulossa Alzheimerin taudin etenemistä hidastavia lääkkeitä. Miten ne kytkeytyvät APOE-geeniin?
”Kyllä, esimerkkinä anti‑amyloidi‑vasta‑ainelääkkeet. Näissä lääkkeissä on ongelmana se, että niitä ei voida turvallisesti kohdentaa henkilöille, jotka ovat APOE ε4/ε4 ‑homotsygootteja. Syynä on se, että lääkkeen tietyt haittavaikutukset ovat heillä niin voimakkaita, että ne ylittävät hoidon mahdolliset hyödyt. Tämän vuoksi APOE ε4/ε4 ‑homotsygootit on jo suljettu pois lääkkeiden käyttäjistä esimerkiksi Isossa‑Britanniassa. Käytännössä tämä tarkoittaa sitä, että juuri ne henkilöt, jotka kuuluvat merkittävimmän geneettisen riskin ryhmään, jäävät edelleen ilman Alzheimerin taudin etenemistä hidastavaa lääkehoitoa”, Hiltunen valittelee.