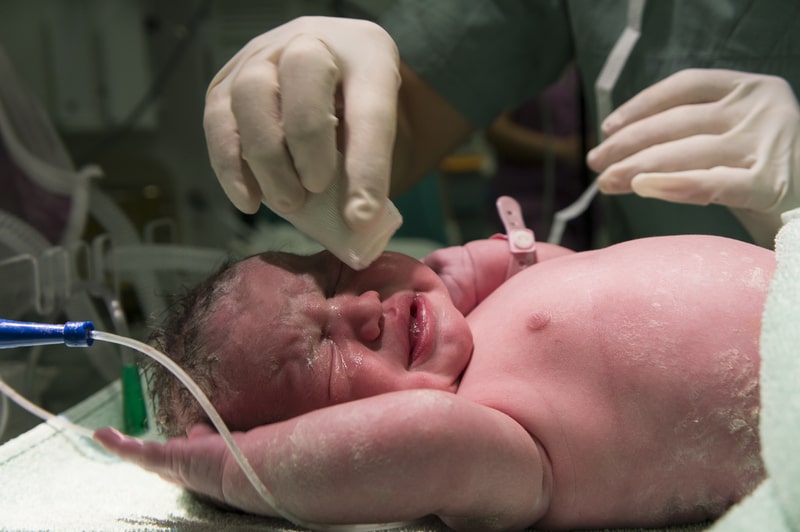

KJ souffrait d’un déficit en carbamoyl-phosphate synthétase 1 (CPS1), une enzyme essentielle au métabolisme de l’ammoniaque. Cette pathologie provoque une forme sévère d’hyperammoniémie néonatale. C’est-à-dire qu’elle empêche l’élimination de l’ammoniaque dans le sang, ce qui entraîne une toxicité potentiellement mortelle dès les premières heures de vie. Sans prise en charge immédiate, les chances de survie sont quasi nulles.
Traditionnellement, la seule option de survie est une greffe du foie, une opération lourde, aux résultats incertains chez un si jeune patient. Mais pour KJ, les médecins de l’Hôpital pour enfants de Philadelphie ont décidé de tenter l’impensable : réécrire son ADN pour corriger le défaut.
Une naissance sous haute urgence Une thérapie génique conçue sur mesure
Face à l’urgence vitale, une équipe de l’Hôpital pour enfants de Philadelphie, en partenariat avec la biotech Carbon Biosciences, a conçu une thérapie génique personnalisée. L’objectif est de corriger la mutation unique identifiée chez KJ grâce à la technologie CRISPR, qui permet de modifier précisément l’ADN.
Le traitement, développé en seulement huit mois, a été administré directement dans le foie, cible principale de l’enzyme défectueuse. Cette intervention a permis une baisse significative des niveaux d’ammoniaque, évitant ainsi la greffe et stabilisant l’état de santé de l’enfant.
Une première mondiale aux implications majeures
Il s’agit de la première fois au monde qu’un traitement génique est entièrement développé pour un seul patient, dans un délai aussi court. Cette approche ouvre la voie à une nouvelle ère de la médecine dite « de précision », dans laquelle les thérapies sont individualisées en fonction du profil génétique de chaque malade.
D’après l’Organisation mondiale de la santé, plus de 300 millions de personnes dans le monde sont touchées par une maladie rare, et 95 % d’entre elles ne disposent d’aucun traitement spécifique. La possibilité de concevoir des traitements à la carte constitue donc une avancée majeure.
Des enjeux scientifiques, éthiques et économiques
Si cette thérapie génique sur mesure constitue une avancée remarquable, elle soulève aussi de nombreuses questions. Tout d’abord sur le plan de la sécurité, quels seront les effets à long terme d’une telle manipulation génétique ? Des suivis réguliers sont en cours pour évaluer l’évolution de l’enfant dans les prochaines années.
Ensuite, sur le plan économique, le coût de développement d’un traitement personnalisé est considérable. À titre d’exemple, la thérapie Zolgensma contre l’amyotrophie spinale, actuellement l’une des plus chères au monde, atteint environ 2 millions d’euros par injection. Ces coûts soulèvent la question de l’accessibilité à ces traitements pour l’ensemble des patients.
Enfin, sur le plan éthique, comment prioriser les patients ? Et comment encadrer ces interventions génétiques dans un cadre réglementaire respectueux des individus et de la société ? Autant de questions que la science doit encore explorer.
À SAVOIR
En France, le dépistage néonatal ne couvre pas encore le déficit en CPS1, responsable de l’hyperammoniémie néonatale. La Haute Autorité de Santé étudie régulièrement l’élargissement de ce programme, notamment pour inclure des maladies rares graves pour lesquelles un traitement existe.


Ma Santé