Et si une simple
perfusion suffisait à libérer des millions de patients du fardeau
quotidien de l’insuline ? Une nouvelle avancée thérapeutique,
encore expérimentale mais prometteuse, pourrait bien transformer à
jamais le traitement du diabète de type 1. Présentée dans The New England Journal of Medicine, cette approche
mise sur des cellules pancréatiques cultivées en laboratoire
capables de restaurer naturellement la production
d’insuline.
Une maladie auto-immune, un
traitement centenaire
Le diabète de type 1 affecte
plus de 8 millions de personnes dans le monde. Contrairement au
diabète de type 2, cette forme
n’est pas liée à un mode de vie sédentaire ou à l’alimentation,
mais à une défaillance du système immunitaire. Celui-ci s’attaque
aux cellules bêta du pancréas, responsables de la production
d’insuline — une hormone vitale qui permet au glucose de pénétrer
dans les cellules et d’y être utilisé comme source d’énergie.
Sans insuline, le sucre
s’accumule dans le sang, provoquant de graves complications :
atteintes nerveuses, rénales, oculaires, voire coma. Depuis plus
d’un siècle, l’unique solution repose sur l’administration
quotidienne d’insuline, par injections ou via des pompes,
accompagnée d’un suivi méticuleux de la glycémie. Un traitement qui
sauve des vies, mais qui n’imite pas parfaitement la régulation
naturelle du corps.
Une solution radicale :
remplacer les cellules perdues
En 2023, un premier pas
important a été franchi avec l’autorisation d’une thérapie
cellulaire utilisant des îlots pancréatiques prélevés sur des
donneurs d’organes. Ces îlots contiennent les fameuses cellules
bêta. Une avancée significative, mais freinée par la rareté des
donneurs et la variabilité de la qualité des greffons.
C’est pour surmonter ces
limites que la biotech américaine Vertex Pharmaceuticals a misé sur
une solution encore plus ambitieuse : produire ces îlots
pancréatiques en laboratoire, à partir de cellules souches
humaines. Une prouesse technique qui ouvre la voie à une production
à grande échelle, standardisée, et théoriquement illimitée.
Des résultats
spectaculaires
Dans un essai clinique mené
auprès de 14 patients atteints de diabète de type 1, 12 ont reçu
une dose complète de ces cellules, désormais appelées zimislecel.
Un an après la perfusion, 10 d’entre eux ont pu interrompre
totalement leur traitement par insuline, tandis que les deux autres
ont réduit leurs doses de 60 à 70 %.
Comment ça fonctionne ?
Injectées dans le foie — qui, étonnamment, semble être un
environnement favorable à leur implantation — les cellules
fabriquées en laboratoire détectent le taux de sucre dans le sang
et sécrètent de l’insuline en conséquence, de manière autonome.
Pour les patients, cela signifie un retour à un équilibre
glycémique quasi naturel.
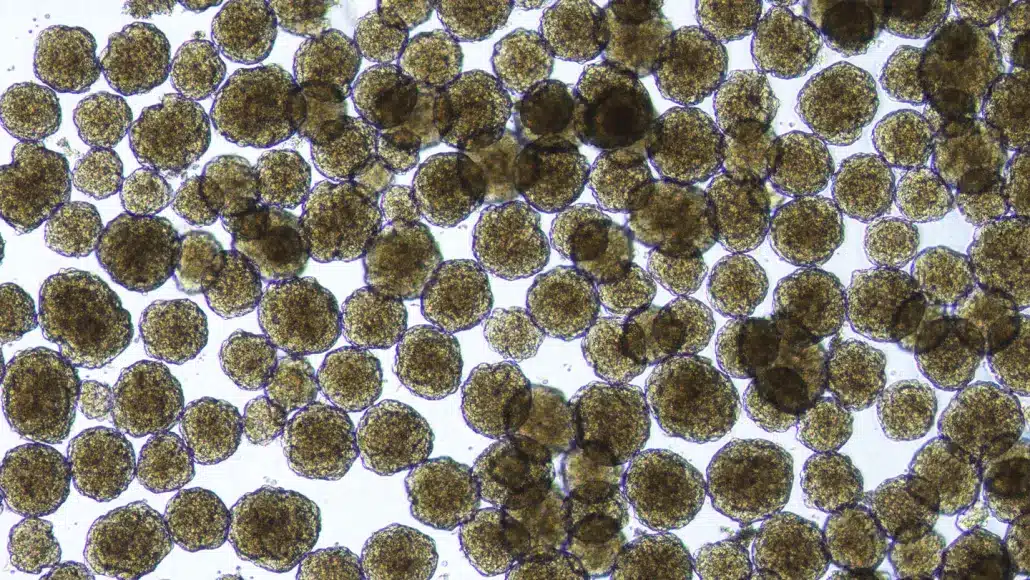
Ces cellules insulaires humaines, créées en laboratoire à partir de
cellules souches, font partie d’une nouvelle thérapie pour les
personnes atteintes de diabète de type 1. Crédits : Vertex
PharmaceuticalsLes limites de
l’approche
Mais cette avancée n’est pas
exempte de défis. Comme toute greffe, cette thérapie nécessite un
traitement immunosuppresseur à vie pour éviter que l’organisme ne
rejette les nouvelles cellules. Ces médicaments peuvent entraîner
des effets secondaires : nausées, diarrhées, vulnérabilité accrue
aux infections… Deux décès ont été recensés dans l’étude, sans lien
direct avec le traitement, selon les chercheurs.
C’est pourquoi nombre de
scientifiques, dont Giacomo Lanzoni de l’Université de Miami,
soulignent l’urgence de développer des solutions qui ne reposent
pas sur l’immunosuppression à long terme. Des pistes sont déjà
explorées, comme encapsuler les cellules dans des dispositifs qui
les protègent du système immunitaire, ou modifier génétiquement les
cellules greffées pour les rendre invisibles à l’organisme.
Vers une révolution
thérapeutique ?
La thérapie de Vertex, bien
qu’encore au stade expérimental, est d’ores et déjà élargie à une
cohorte de 50 patients. L’entreprise espère soumettre une demande
d’autorisation de mise sur le marché dès 2026, en s’appuyant sur
les résultats de cette étude élargie. Si tout se passe comme prévu,
cette méthode pourrait représenter la première thérapie curative du
diabète de type 1.
Plus qu’une innovation
médicale, il s’agit d’un changement de paradigme : passer d’un
traitement palliatif — maintenir artificiellement l’insuline — à
une véritable régénération des fonctions naturelles de
l’organisme.
