Dans la maladie d’Alzheimer, la protéine tau est l’une des grandes coupables : elle s’emmêle, forme des fibrilles toxiques et finit par étouffer les neurones. Ce mécanisme semble relativement bien connu. Pourtant, une équipe de l’université métropolitaine de Tokyo affirme avoir identifié une étape du processus que les chercheurs n’avaient jamais réellement considérée. Une étape précoce, plus discrète… mais peut-être décisive. L’étude a été publiée dans Neuroscience Research.
Ce que l’on sait de la protéine tau
La protéine tau est essentielle au bon fonctionnement des neurones : elle stabilise les microtubules, ces sortes de rails internes qui permettent au neurone de transporter nutriments et signaux. Mais lorsqu’elle se replie mal, tau s’agrège en fibrilles rigides qui encombrent les cellules nerveuses et perturbent leur fonctionnement.
Jusqu’à présent, la recherche s’est surtout concentrée sur ces fibrilles toxiques, visibles et durables. Le problème, c’est qu’une fois formées, elles sont extrêmement difficiles à éliminer et résistent largement aux traitements. Ce que l’on comprenait moins bien, en revanche, c’était ce qui se passait avant leur apparition.
Quand la physique des polymères s’invite dans la recherche sur Alzheimer
Pour comprendre ce que les chercheurs ont observé, il faut faire un détour par un domaine scientifique inattendu : la physique des polymères. Dans ce champ, on sait que les matériaux ne se cristallisent pas soudainement. Avant de former une structure ordonnée, ils passent par des états intermédiaires, un peu comme des brouillons avant de former une structure finale et ordonnée.
L’équipe du professeur Rei Kurita a eu l’idée de regarder la protéine tau avec ce regard-là : non pas comme une molécule qui passe directement de « normale » à « fibrillaire », mais comme une chaîne pouvant s’organiser par étapes successives.
En observant la protéine tau avec des techniques de diffusion de rayons X et des analyses de fluorescence, les chercheurs ont découvert un phénomène similaire : d’abord, tau forme des micro-amas de quelques dizaines de nanomètres, ensuite seulement, ces amas se transforment en fibrilles caractéristiques d’Alzheimer.
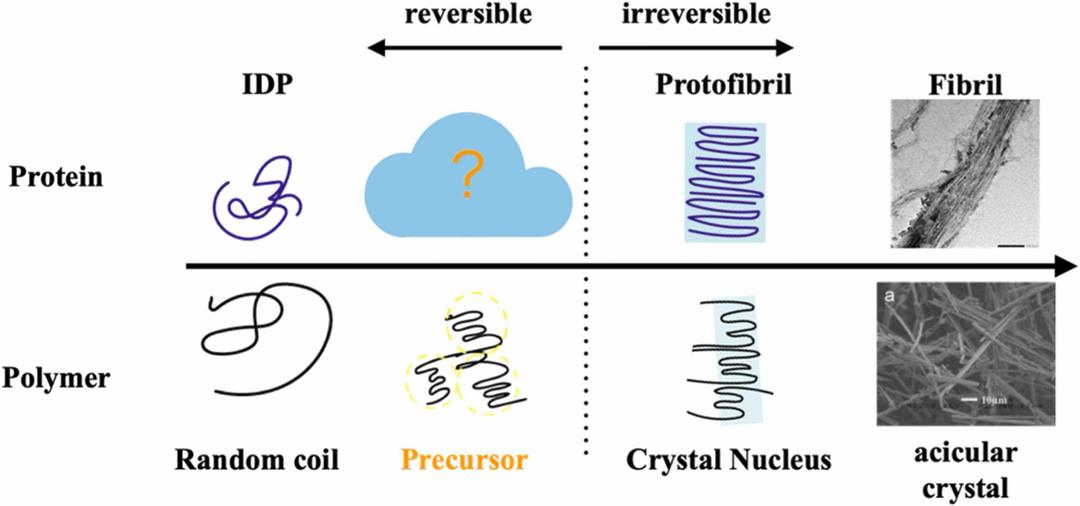
L’équipe du professeur Rei Kurita a observé que tau ne forme pas directement des fibrilles, mais des amas souples comparables aux étapes intermédiaires des polymères. En ciblant ces premiers assemblages, ils ont réussi à stopper le mécanisme menant aux dégâts d’Alzheimer. © Tokyo Metropolitan University
Dissoudre les premiers amas pour empêcher la suite
L’avancée majeure vient de l’expérience qui a suivi. En modifiant simplement la quantité de sel dans la solution et la façon dont la protéine tau interagit avec l’héparine, un anticoagulant naturel, les chercheurs ont réussi à désorganiser les nano-agrégats. Résultat : les fibrilles ne se formaient presque plus.
L’équipe a suggéré que « cet effet s’explique par le fait que l’augmentation de la concentration d’ions chargés réduit l’intensité des interactions entre les protéines tau et l’héparine ». Selon leur explication, « cette modification renforce l’effet d’écran électrostatique, ce qui rend plus difficile la rencontre des molécules et la formation d’agrégats ».
Cette étude montre qu’il serait peut-être plus efficace de cibler le stade précoce, lorsque les amas restent encore fragiles et faciles à dissoudre. Une telle approche pourrait transformer la manière dont on conçoit les traitements d’Alzheimer, et pourrait même s’appliquer à d’autres maladies neurodégénératives comme Parkinson.