Pendant des décennies, près de la moitié de notre génome a été considérée comme un vestige évolutif sans fonction particulière. Cet ADN dit « poubelle » était relégué au rang de curiosité biologique, un déchet génétique hérité de notre passé. Aujourd’hui, une équipe internationale du King’s College de Londres vient de démontrer que ces fragments autrefois méprisés pourraient devenir l’arme secrète contre certains cancers du sang parmi les plus tenaces. Cette découverte, publiée dans la revue Blood, transforme radicalement notre compréhension du génome et ouvre des perspectives thérapeutiques totalement inédites.
L’ADN poubelle : une erreur de jugement historique
Durant la majeure partie du 20e siècle, les biologistes se sont concentrés exclusivement sur les gènes codants, ces portions d’ADN qui contiennent les instructions pour fabriquer des protéines. Tout le reste, soit environ 98% du génome humain, semblait dépourvu d’utilité évidente. Incapables d’y déceler une fonction claire, les scientifiques l’ont baptisé « ADN poubelle » ou « ADN non codant ».
Cette vision s’est progressivement effondrée au cours des dernières années. Les chercheurs ont découvert que ces régions apparemment inertes jouent en réalité des rôles cruciaux dans la régulation de l’expression des gènes, contrôlant quand et comment les protéines sont produites dans nos cellules.
Parmi ces séquences non codantes figurent les éléments transposables, des fragments d’ADN capables de se déplacer d’un endroit à l’autre du génome. Ces véritables nomades génétiques peuvent se détacher d’une partie de notre ADN et s’insérer ailleurs, un comportement qui semblait chaotique et dénué de sens.
Des cancers particulièrement redoutables
L’étude s’est concentrée sur deux formes de cancers du sang notoirement difficiles à traiter : le syndrome myélodysplasique et la leucémie lymphoïde chronique. Ces pathologies présentent une caractéristique qui complique considérablement leur prise en charge médicale.
Elles sont causées par des mutations dans les gènes ASXL1 et EXH2, qui endommagent la machinerie cellulaire de manière insidieuse. Ces mutations empêchent la production normale de certaines protéines, déclenchant une prolifération cellulaire anarchique et une cascade d’instabilités génétiques.
Le problème majeur pour les oncologues réside dans le fait que ces gènes mutés ne fabriquent plus les protéines que les thérapies anticancéreuses conventionnelles cibleraient habituellement. Sans cible moléculaire claire, ces cancers deviennent extrêmement difficiles à combattre avec les approches traditionnelles.
Le réveil inattendu de l’ADN dormant
En utilisant des modèles de souris portant ces cancers ainsi que des cellules cancéreuses humaines cultivées en laboratoire, les chercheurs ont fait une observation surprenante. Les mutations dans ASXL1 et EXH2 ne se contentaient pas de perturber la production de protéines : elles réactivaient également l’ADN poubelle.
Plus précisément, ces mutations déclenchaient une duplication et une propagation effrénée des éléments transposables. Ces fragments d’ADN autrefois dormants se mettaient soudainement à sauter partout dans le génome des cellules cancéreuses, s’insérant de manière anarchique dans leur ADN.
Ce comportement débridé génère un stress cellulaire considérable. Imaginez un système informatique où des fichiers se copieraient et se colleraient aléatoirement dans tous les dossiers : c’est exactement ce qui se produit dans ces cellules cancéreuses.
Une faiblesse à exploiter
Face à ce chaos génétique, les cellules cancéreuses doivent trouver un moyen de survivre. Pour gérer le stress provoqué par cette activité frénétique des éléments transposables, elles deviennent fortement dépendantes d’un système de réparation particulier : les protéines PARP, qui réparent les dommages à l’ADN.
C’est précisément cette dépendance qui constitue leur talon d’Achille. Les inhibiteurs de PARP sont des médicaments déjà utilisés contre d’autres formes de cancer. En bloquant ce système de réparation dont les cellules cancéreuses sont devenues dépendantes, ces médicaments les condamnent à mort.
Les expériences menées par l’équipe du King’s College ont montré que ces inhibiteurs de PARP éliminaient efficacement les deux types de cancers du sang testés. Encore plus encourageant, les cellules saines étaient majoritairement épargnées par le traitement, suggérant une sélectivité thérapeutique précieuse.
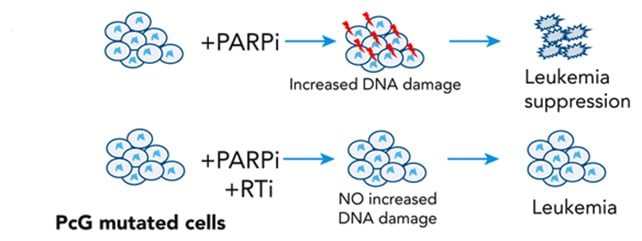 Crédit : Zeisig et al., Blood , 2025Les chercheurs ont bloqué le système de réparation utilisé par les cellules cancéreuses pour réparer les dommages à l’ADN (première rangée), ce qui a permis d’éliminer le cancer.Une approche qui pourrait révolutionner l’oncologie
Crédit : Zeisig et al., Blood , 2025Les chercheurs ont bloqué le système de réparation utilisé par les cellules cancéreuses pour réparer les dommages à l’ADN (première rangée), ce qui a permis d’éliminer le cancer.Une approche qui pourrait révolutionner l’oncologie
Chi Wai Eric So, biologiste au King’s College de Londres et auteur principal de l’étude, voit dans cette découverte un potentiel considérable. Elle offre un nouvel espoir aux patients atteints de cancers difficiles à traiter en utilisant des médicaments existants d’une manière totalement inédite.
L’approche transforme ce qui était autrefois perçu comme un ADN inutile en une cible thérapeutique puissante. Les chercheurs qualifient ce mécanisme de « létalité synthétique » : en exploitant une vulnérabilité spécifique créée par les mutations cancéreuses, on peut éliminer sélectivement les cellules malades.
Les scientifiques sont convaincus que leurs découvertes s’étendent probablement au-delà de ces deux cancers du sang. Les inhibiteurs de PARP étant déjà employés contre diverses formes de cancer, il est possible que ce mécanisme impliquant l’ADN poubelle joue un rôle plus large qu’on ne l’imagine actuellement.
L’ADN poubelle se révèle précieux
Cette étude s’inscrit dans une tendance plus générale de réhabilitation de l’ADN non codant. Des recherches récentes ont démontré que les éléments transposables, qui représentent près de la moitié du génome humain, participent à la régulation des défenses immunitaires, aident le cerveau à gérer la peur et protègent même les espèces contre l’hybridation.
Ce qui semblait être un vestige évolutif sans importance se révèle être un acteur majeur de nombreux processus biologiques fondamentaux. L’ADN poubelle mérite définitivement un nouveau nom, plus respectueux de son rôle réel dans le fonctionnement de nos cellules.
Il reste néanmoins essentiel de souligner que ces résultats proviennent d’expériences sur des cellules cultivées en laboratoire et des modèles animaux. Des recherches supplémentaires seront nécessaires pour valider l’efficacité de cette approche chez les patients humains avant d’envisager son application clinique généralisée.