di
Ruggiero Corcella
L’intervento, descritto sul Journal of Hepatology, è stato effettuato dall’equipe del professor Beicheng Sun della Anhui Medical University, Hefei (Cina). L’organo ha ricevuto 10 modificazioni genetiche e ha funzionato bene per 38 giorni. Il paziente è deceduto dopo 133 giorni per una serie di complicazioni
Dopo cuore, reni e polmone mancava una prova su «vivente» per il fegato. Ed è arrivata dalla Cina oramai chiaramente in competizione con gli Usa nella corsa allo xenotrapianto. Il trapianto di un fegato geneticamente modificato di maiale in un paziente umano vivente segna una svolta storica per la medicina rigenerativa e i trapianti. L’operazione, condotta in Cina e descritta sul Journal of Hepatology, è durata 171 giorni, il periodo più lungo mai registrato per un xenotrapianto epatico funzionante nell’uomo.
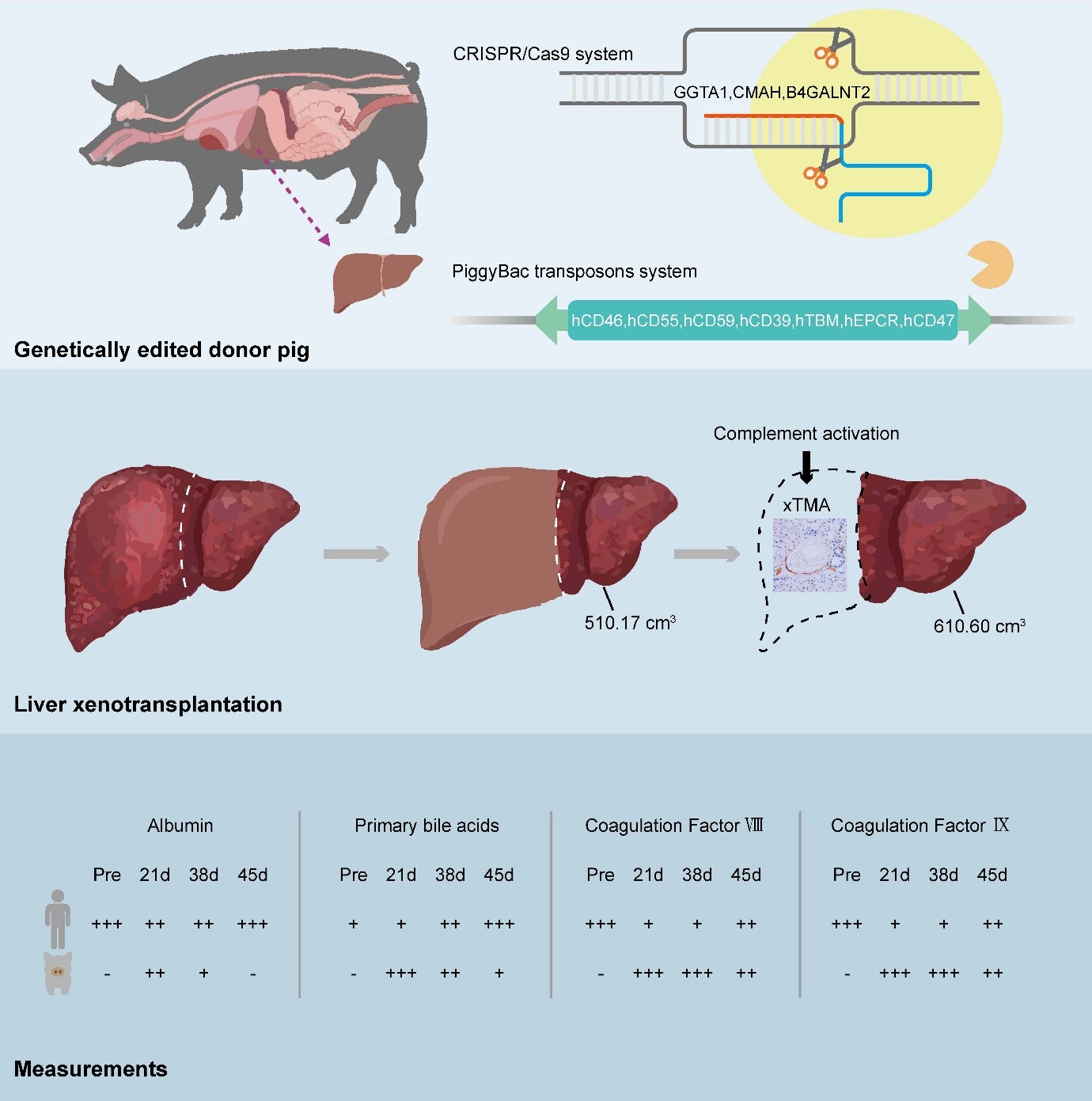
Il paziente, un uomo di 71 anni affetto da cirrosi epatica dovuta all’epatite B e da carcinoma epatocellulare, non era idoneo a un trapianto umano. I chirurghi hanno impiantato un fegato ausiliario proveniente da un maiale miniatura Diannan, modificato con 10 alterazioni genetiche: eliminate alcune molecole responsabili del rigetto interspecie e introdotti geni umani per migliorare la compatibilità immunitaria e della coagulazione.
Per le prime settimane il fegato ha funzionato in modo efficace, producendo bile e sintetizzando fattori della coagulazione, senza segni di rigetto acuto. Poi, al giorno 38, è comparsa una microangiopatia trombotica associata a xenotrapianto (xTMA), complicanza legata all’attivazione del complemento e a danni endoteliali. Il trattamento con eculizumab e plasmaferesi ha temporaneamente risolto il problema, ma il paziente ha sviluppato successivamente emorragie gastrointestinali ricorrenti ed è morto al 171esimo giorno.
«Questo caso dimostra che un fegato di maiale geneticamente modificato può funzionare in un essere umano per un periodo prolungato», spiega il professor Beicheng Sun, responsabile dell’équipe di ricerca e presidente del First Affiliated Hospital of Anhui Medical University, Hefei (Cina) .
«È una pietra miliare per l’epatologia», aggiunge in un editoriale Heiner Wedemeyer, co-editor del Journal of Hepatology: «mostra che un fegato suino può attecchire e svolgere funzioni chiave, ma restano da affrontare sfide biologiche, immunologiche ed etiche prima che questi trapianti possano entrare nella pratica clinica».
«La pubblicazione di questo caso conferma il Journal of Hepatology come la principale rivista al mondo dedicata alle malattie del fegato», aggiunge Vlad Ratziu, MD, PhD, direttore editoriale della rivista e docente alla Sorbona e all’Ospedale Pitié-Salpêtrière di Parigi. «Siamo impegnati a presentare scoperte di frontiera che ridefiniscono ciò che è possibile in epatologia».
Funzione dell’organo
Il trapianto ha prodotto bile, albumina e fattori della coagulazione rilevabili nel siero del paziente. L’albumina suina era funzionalmente attiva e contribuiva alla pressione oncotica plasmatica. La presenza di acidi biliari e proteine specifiche suine conferma un metabolismo attivo del trapianto.
Nel complesso, il fegato xenogenico ha svolto funzioni epatiche essenziali, seppure in modo temporaneo.
Aspetti tecnici e di biosicurezza
I maiali donatori erano animali clonati con dieci geni modificati, capaci di trasmettere i transgeni umani alla loro progenie, un vantaggio per la produzione su larga scala ma con importanti implicazioni regolatorie e di biosicurezza. Erano allevati in ambienti privi di patogeni specifici e sottoposti a un ampio screening microbiologico. Un’attenzione particolare è stata riservata ai retrovirus endogeni suini (PERV), poiché i sottotipi A, B e C possono avere potenziale patogeno. La completa inattivazione di tutti i sottotipi è considerata preferibile. Alcuni maiali di altri allevatori, come Revivicor o Chengdu Clonorgan, presentano ancora sequenze PERV-A e PERV-B, il che sottolinea la necessità di mantenere un alto livello di sorveglianza.
Lo xenotrapianto nel contesto storico
Scrivono Heiner Wedemeyer, Frank Tacke, Phil Newsome e Vlad Ratziu, nel loro editoriale: «Per decenni lo xenotrapianto è stato studiato come possibile soluzione alla cronica carenza di organi. Negli ultimi tre anni sono stati riportati trapianti di cuore e di rene da maiale a uomo con esiti positivi, ma il fegato ha sempre presentato difficoltà specifiche. Oltre alle barriere immunologiche, l’organo epatico comporta incompatibilità fisiologiche complesse legate alle sue funzioni enzimatiche, sintetiche e reticolo-endoteliali.
«I progressi nella trasferenza nucleare di cellule somatiche hanno consentito di ridurre parte di queste incompatibilità, portando alla recente autorizzazione della Fda per l’uso di maiali geneticamente modificati come potenziali donatori d’organi. Le modifiche genetiche principali mirano a evitare il rigetto iperacuto (disattivazione del gene dell’α-1,3-galattosiltransferasi) e a prevenire complicazioni vascolari e infiammatorie, grazie all’inserimento di geni umani che inibiscono complemento, coagulazione e infiammazione. Tuttavia, nei modelli animali di trapianto di fegato da maiale a primate, la sopravvivenza si è limitata a pochi giorni o settimane, molto inferiore a quella dei trapianti di cuore o di rene xenogenici.
«Per questo motivo la maggior parte dei ricercatori considera il fegato suino come un organo “ponte”, utile nei casi di insufficienza epatica acuta (ALF), sindrome “small-for-size” dopo resezione estesa o insufficienza epatica acuta-su-cronica (ACLF). Il primo studio clinico per testare un fegato di maiale extracorporeo come supporto temporaneo di 72 ore nei pazienti con ACLF dovrebbe iniziare alla fine del 2025».
L’urgenza: troppi pazienti e pochi organi
Secondo l’Organizzazione mondiale della sanità, migliaia di pazienti muoiono ogni anno in attesa di un trapianto. In Cina, centinaia di migliaia di persone sviluppano insufficienza epatica ogni anno, ma solo circa seimila ricevono un fegato. Il disequilibrio tra domanda e disponibilità è la ragione per cui la xenotrapiantologia — i trapianti tra specie — sta ricevendo nuovo impulso.
Negli ultimi anni, esperimenti di trapianto di cuore e rene di maiale in esseri umani hanno mostrato che la barriera immunologica può essere superata almeno temporaneamente grazie all’ingegneria genetica. La scelta di un modello ausiliario, in cui l’organo del paziente resta in sede, apre la strada a strategie «ponte» per i casi di insufficienza epatica acuta o di attesa prolungata di un organo umano.
Un cambiamento che coinvolge anche società e bioetica
Accanto ai progressi scientifici, si muove un fronte parallelo: quello normativo ed etico. Come scrivono nell’editoriale sul Journal of Hepatology, a proposito delle domande cruciali che il nuovo xenotrapianto di fegato solleva, una è molto importante: «Come affrontare in modo aperto le questioni etiche, culturali e religiose che accompagnano lo xenotrapianto?Serve un dialogo trasparente che coinvolga medici, scienziati, pazienti, decisori politici e società civile».
Al congresso internazionale dell’IXA (International Xenotransplantation Association), tenutosi a Ginevra nell’ottobre scorso, gli esperti hanno affrontato tutti questi argomenti. IXA sta rivedendo le linee guida globali per l’uso clinico degli organi animali. La priorità è garantire sicurezza, trasparenza e tracciabilità: chi riceve un organo xenogenico dovrà essere seguito a vita, per evitare rischi di infezioni zoonotiche o complicazioni tardive.
Le indagini internazionali (QUI, l’articolo) mostrano che i pazienti più gravi si dichiarano in larga parte favorevoli all’uso di organi animali, purché i protocolli siano sicuri. Nella popolazione generale, invece, prevalgono dubbi etici e timori per la «contaminazione» tra specie. In molti Paesi, i comitati etici stanno lavorando per costruire un consenso informato più solido, elemento indispensabile per futuri trial clinici.
La prospettiva scientifica: dal fegato ai trial clinici su larga scala
Tra i ricercatori, cresce la convinzione che i primi studi clinici controllati su larga scala per xenotrapianti renali o epatici possano iniziare entro pochi anni. Leonardo Riella, direttore del programma di trapianti del Massachusetts General Hospital, ritiene che le modifiche genetiche introdotte negli ultimi modelli animali e le nuove terapie immunosoppressive possano «trasformare la xenotrapiantologia da esperimento isolato a opzione clinica concreta entro tre-cinque anni».
Il trapianto epatico da maiale non è ancora una terapia, ma un esperimento di confine. Tuttavia, per la prima volta, un organo animale ha funzionato a lungo in un essere umano, confermando che il principio è tecnicamente valido.
Una rivoluzione da governare
Il passo compiuto dal team cinese segna l’inizio di una nuova fase. Dopo decenni di fallimenti dovuti a rigetto fulminante e incompatibilità biologiche, la genetica di nuova generazione e i protocolli immunosoppressivi stanno ridefinendo ciò che sembrava impossibile.
Le sfide restano enormi — dal controllo della coagulazione alle complicanze immunitarie — ma il trapianto di fegato suino dimostra che la biologia sintetica può sostenere la vita umana. La vera domanda, oggi, non è più se sia possibile: è come, quando e per chi sarà lecito e sicuro farlo.
In questa frontiera, dove scienza e bioetica si incontrano, si gioca uno dei passaggi più delicati della medicina moderna.
9 ottobre 2025 ( modifica il 9 ottobre 2025 | 14:50)
© RIPRODUZIONE RISERVATA