Nel giugno 2025 il comitato consultivo sui vaccini dei Centri per il controllo e la prevenzione delle malattie (CDC) si è riunito per la prima volta dopo le nuove nomine decise dal Segretario alla Salute, Robert F. Kennedy Jr.
Kennedy aveva promesso una svolta: più trasparenza, più rigore scientifico e stop alla “cultura del timbro di gomma” che da anni caratterizzava le decisioni su vaccini e farmaci.
La decisione sull’anticorpo anti-RSV
Al centro della prima seduta è finito il nuovo anticorpo monoclonale contro il virus respiratorio sinciziale (RSV), prodotto da Merck e quasi identico a quello della Sanofi, approvato nel 2023. Il CDC ha garantito che non vi fossero “problemi di sicurezza” e ciò ha contribuito a una rapida approvazione: 5 voti favorevoli, 2 contrari. La nuova direttrice del CDC, Susan Monarez, ha immediatamente ratificato la raccomandazione, aprendo la strada alla somministrazione nazionale dal prossimo inverno.
Uno dei due voti contrari è arrivato dal professor Retsef Levi, che ha richiamato l’attenzione su un andamento riscontrato in quattro importanti studi clinici: MEDLEY , MELODY , HARMONIE di Sanofi e CLEVER di Merck .
In ciascuno di essi si è verificato un aumento degli eventi avversi neurologici, principalmente convulsioni, nei gruppi trattati rispetto ai controlli. “Non dovremmo preoccuparci di questi potenziali segnali di sicurezza?”, ha chiesto Levi durante la seduta.
La risposta della Merck, rappresentata dal dottor Anushua Sinha, è stata rassicurante: gli eventi sarebbero stati analizzati “approfonditamente” e giudicati non correlati al farmaco. In pratica, all’ACIP veniva chiesto di fidarsi della parola dell’azienda. Levi ha riconosciuto che i numeri degli studi clinici erano esigui e ha indicato che la sua decisione sarebbe dipesa dai dati di sorveglianza post-marketing.
I dati post-marketing del CDC
Il CDC ha quindi mostrato i dati di sorveglianza post-marketing del Vaccine Safety Datalink (VSD), relativi al nirsevimab (anticorpo Sanofi già approvato). La presentazione, affidata a Matthew Daley (Kaiser Permanente Colorado, organizzazione finanziata da Sanofi), ha mostrato grafici in cui compariva anche l’esito più discusso: le convulsioni.
- Nei neonati 0–37 giorni, il rischio era 3,5 volte maggiore, ma non statisticamente significativo.
- Nei bambini 38 giorni–8 mesi, il rischio era 4,38 volte maggiore, anch’esso non significativo.
Daley ha concluso che non vi fossero “aumenti significativi del rischio”.
Il dato che non è stato mostrato
Quello che non è stato presentato ai membri del comitato è cruciale.
Combinando i due gruppi in un’unica analisi meta-analisi, emerge un dato ben diverso: quasi 4 volte più probabilità di convulsioni dopo l’iniezione (3,93; IC 95% 1,21–12,79; p=0,02). Questo risultato è statisticamente significativo (p=0,02), il che rende improbabile che si tratti di una scoperta casuale, come confermato da tre esperti indipendenti.
Un risultato si definisce statisticamente significativo quando la probabilità che l’effetto osservato sia dovuto al caso è molto bassa, secondo una soglia convenzionale chiamata p-value.
- La soglia più usata è p , cioè meno del 5% di probabilità che il risultato sia frutto del caso.
Un altro strumento è l’intervallo di confidenza (IC), che indica il range in cui con alta probabilità (di solito 95%) si trova il “vero” valore dell’effetto.
- Se un rischio relativo (RR) o una odds ratio (OR) ha un IC che non include 1, il risultato è statisticamente significativo. Esempio: RR = 3,9; IC 95% 1,2–12,8 → significativo, perché l’IC non contiene 1.
- Se fosse RR = 3,9; IC 95% 0,8–12,8 → non significativo, perché il valore 1 è incluso (non possiamo escludere che il rischio sia uguale tra gruppi).
Dividendo invece i casi di convulsioni in due gruppi, il segnale di allarme è di fatto svanito.
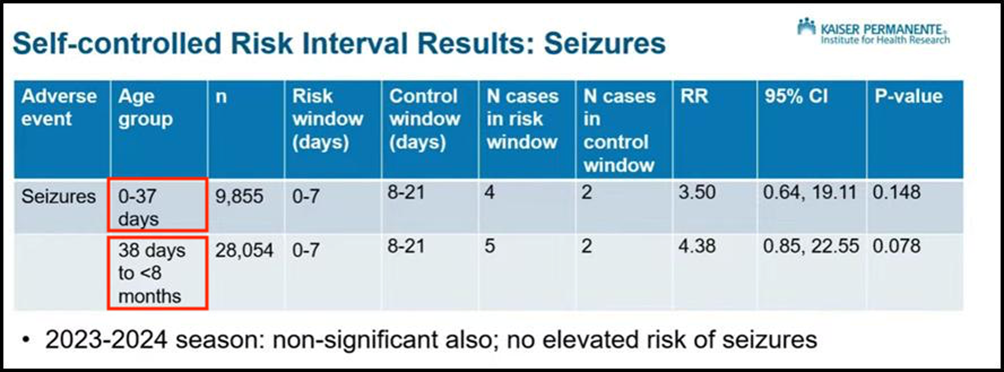
Ai membri dell’ACIP non è mai stato mostrato il risultato complessivo. La scelta di dividere i dati in un limite arbitrario di 37 giorni appare priva di giustificazione biologica, alimentando il sospetto di una decisione post hoc per attenuare un segnale di allarme scomodo.
È stato utilizzato un modello di intervallo di rischio autocontrollato, contando le crisi solo nella prima settimana dopo l’iniezione (giorni 0-7) e trattando le due settimane successive (giorni 8-21) come periodo di “controllo”. Supponiamo che si sia verificata una crisi epilettica l’ottavo giorno. Verrebbe conteggiata come parte del periodo di controllo, il che implica che non è correlata all’iniezione, anche se potrebbe essere stata causata da essa. In queste situazioni è consuetudine variare la finestra di rischio. Limitando così la finestra di rischio a soli sette giorni, le reazioni avverse reali potrebbero essere erroneamente classificate come eventi di base, facendo apparire il prodotto più sicuro di quanto non sia in realtà.
Se i membri dell’ACIP avessero visto sia i dati completi, che mostravano uno squilibrio costante nei danni al sistema nervoso, sia i dati aggregati sulle crisi epilettiche che dimostravano un rischio statisticamente significativo, avrebbero potuto riconoscere un chiaro segnale di sicurezza e votare diversamente.
Con un margine di voto di soli 5 a 2, se anche due membri fossero stati informati del segnale statistico completo, la raccomandazione avrebbe potuto essere bloccata. Dopo che è emersa la notizia dell’analisi omessa, alcune fonti riferiscono che diversi membri dell’ACIP si siano dichiarati preoccupati e delusi per non aver ricevuto il quadro completo.
Silenzi e conflitti di interesse
Né Daley né il CDC hanno fornito chiarimenti sul perché i dati siano stati divisi e sul perché non sia stata mostrata l’analisi combinata.
L’HHS, attraverso il portavoce Andrew Nixon, ha ribadito che il processo decisionale ACIP sarebbe “basato sulla trasparenza e sul rigore scientifico” e che la sorveglianza continuerà. Ma per molti osservatori, questo episodio rischia di dimostrare l’opposto.
Il possibile rischio di convulsioni potrebbe rappresentare un evento avverso, applicabile a tutti gli anticorpi monoclonali anti-RSV. Ciò significa che milioni di neonati in tutto il mondo potrebbero essere coinvolti.
