Estrutura cerebral em forma de amêndoa com cerca de 1,5 cm de comprimento em seres humanos, a amígdala teve sua conexão com a ansiedade amplamente documentada na literatura científica a partir dos anos 1990, com o surgimento da neuroimagem funcional (fMRI).
No entanto, embora a ansiedade seja um transtorno psiquiátrico muito comum no mundo atual, ainda não se sabia até agora como exatamente a amígdala estava associada a essa alteração comportamental, ou seja, quais neurônios, quais circuitos e quais mecanismos moleculares causavam o problema.
Em um estudo publicado em maio de 2025 na revista iScience, uma equipe de pesquisadores do Instituto de Neurociências de Alicante (IN), na Espanha, conseguiu identificar essa conexão: uma população singular de neurônios na amígdala cerebral que, quando desregulados, desencadeiam comportamentos patológicos.
Isso significa que, dentro de cada amígdala — uma vez que são, na verdade, duas estruturas, uma em cada lobo temporal — existe um grupo de neurônios conhecidos como “células de disparo regular”, um tipo funcional definido principalmente pela forma como disparam impulsos elétricos quando ativadas.
Diferentemente das células de disparo tardio, que, quando estimuladas, “pensam” antes de soltar seus potenciais de ação ao longo do axônio do neurônio, as de disparo regular começam a disparar esses impulsos elétricos de forma imediata, rítmica e constante, como o tique-taque de um relógio.
Curando a ansiedade em ratos transgênicos
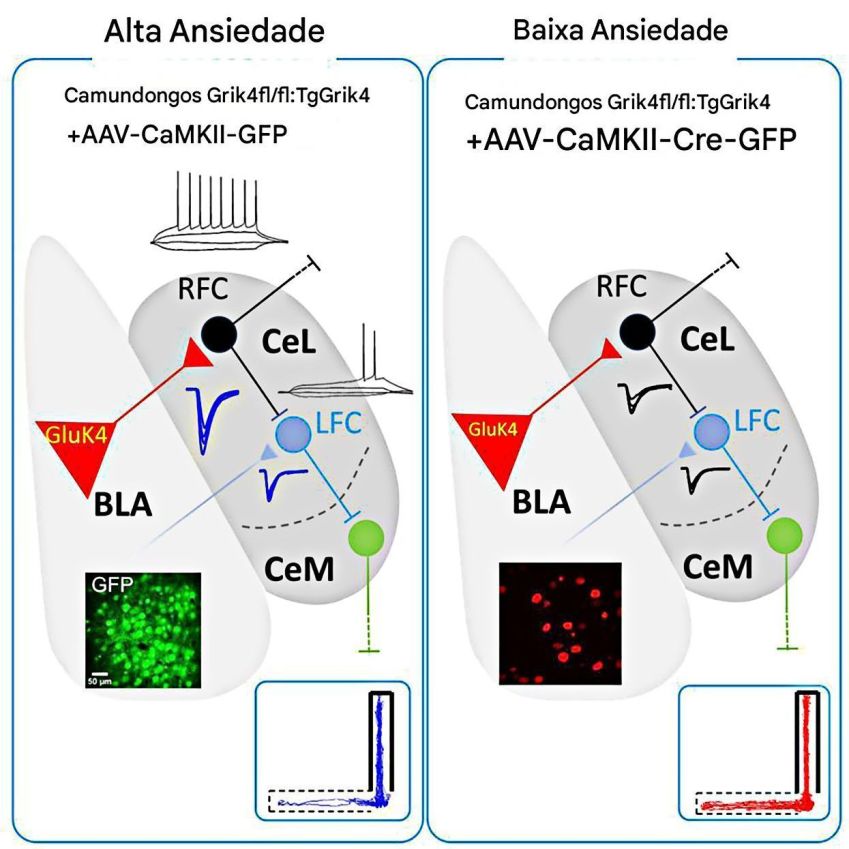 Resumo gráfico do trabalho mostra que a hiperatividade das células regulares desliga o freio das células tardias e dispara a ansiedade • Álvaro García, iScience, 2025/Reprodução
Resumo gráfico do trabalho mostra que a hiperatividade das células regulares desliga o freio das células tardias e dispara a ansiedade • Álvaro García, iScience, 2025/Reprodução
Para testar suas hipóteses, os pesquisadores, liderados por Juan Lerma no Instituto de Neurociências, usaram uma linhagem transgênica de ratos desenvolvida e caracterizada no mesmo laboratório em 2015, com cópias extras do gene Grik4, a mesma alteração genética verificada naturalmente em humanos com autismo e esquizofrenia.
No cérebro desses camundongos geneticamente modificados, os neurônios da amígdala basolateral enviam sinais muito mais fortes (até 182% mais intensos) para as células de disparo regular. Como resultado, a proteína GluK4 produzida em dobro causa hiperexcitabilidade neuronal e comportamentos de ansiedade.
Como os camundongos transgênicos tinham o gene Grik4 duplicado —ou seja, produziam o dobro de GluK4 — os autores do estudo atual fizeram uma manipulação genética que removeu as cópias nativas do gene, deixando apenas as cópias extras, o que, na prática, resultou em uma produção normal de GluK4.
A equipe ajustou a produção da proteína especificamente em uma pequena região do cérebro (a amígdala basolateral), o que fez com que essa região parasse de enviar sinais excessivos para outro grupo de neurônios (as células de disparo regular).
Para o primeiro autor do estudo, Álvaro García, do IN, “esse simples ajuste foi suficiente para reverter comportamentos relacionados à ansiedade e déficits sociais [nos camundongos], o que é notável”. Segundo ele, isso demonstra que não foi preciso mexer no cérebro inteiro, apenas em um circuito crítico.
Funcionamento e possíveis aplicações
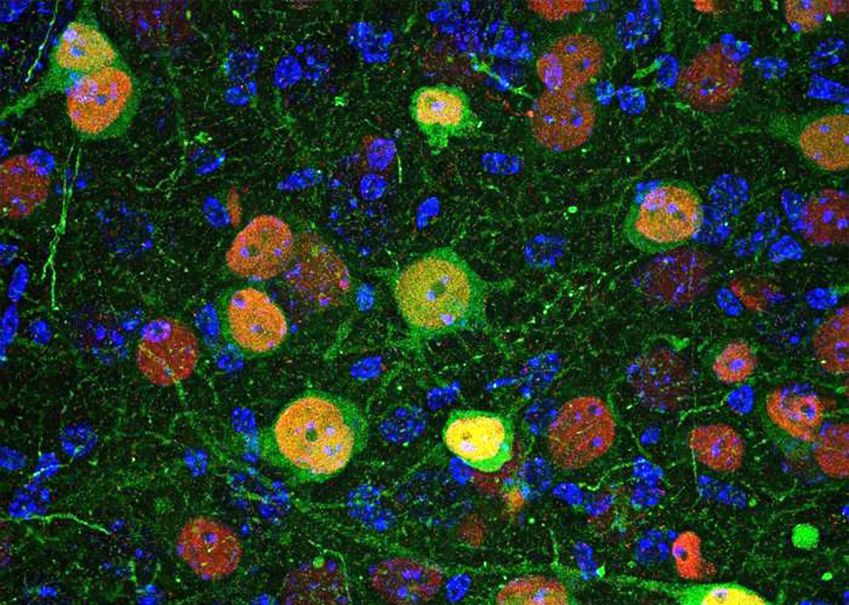 Imagem de microscopia confocal mostrando células da amígdala basolateral infectadas por um vírus geneticamente modificado • Instituto de Neurociências UMH CSIC/Divulgação
Imagem de microscopia confocal mostrando células da amígdala basolateral infectadas por um vírus geneticamente modificado • Instituto de Neurociências UMH CSIC/Divulgação
A dinâmica por trás dessa “cura” da ansiedade em camundongos é o fato de as células de disparo regular inibirem vigorosamente as células de disparo tardio. É como se as rápidas “desligassem” as de disparo tardio, e estas, por sua vez, inibissem os neurônios da amígdala centromedial, que geram as respostas de ansiedade.
Em uma situação ideal, uma ativação moderada das células regulares na amígdala basolateral faz com que elas inibam as células tardias. Estas fazem uma espécie de “pausa para pensar” antes do primeiro impulso elétrico, mantendo sob controle a amígdala centromedial, responsável pelas respostas de saída.
Isso faz com que a ansiedade se mantenha em níveis normais e adaptativos, segundo o estudo. Na prática, a ansiedade não surge porque as células regulares disparam de forma “regular”, mas porque quando elas ficam hiperativas, dominam o circuito, suprimem as células tardias, e comprometem o controle da ansiedade.
Embora esses resultados tenham ocorrido em modelos animais, a descoberta tem implicações profundas em futuros tratamentos farmacológicos direcionados. Hoje os medicamentos para ansiedade e depressão agem de forma generalizada no cérebro, afetando múltiplos sistemas.
Contudo, a identificação de uma população neuronal específica e do receptor molecular envolvido (GluK4) abre caminhos para o desenvolvimento de fármacos que modulem seletivamente esse circuito, com menos efeitos colaterais. O mesmo poderá ser feito em neuromodulação com estimulação transcraniana.
Além desses tratamentos potenciais, descobrir que uma população tão pequena de neurônios pode ter um controle desproporcional sobre a regulação emocional muda radicalmente nossa compreensão de como ansiedade e depressão funcionam no cérebro. Não mais como “danos estruturais”, mas como descompassos focais.